오피니언
CAR-T 세포, 떠오르는 암세포 '연쇄살인마'
바이오스펙테이터 김성민 기자
성큼 다가온 4세대 면역세포 치료제 시대
'살아있는 약물(Living drug)' '연쇄살인마'
면역세포치료제 CAR-T(Chimeric antigen receptor-T, 키메릭 항원 수용체 발현 T 세포)가 가진 별명으로 기존 항암제와 달리 계속 투여하지 않아도 되는 특징 때문에 붙여진 것이다.
최근 4세대 항암제로 면역세포치료제가 스포트라이트를 받고 있다. 면역세포치료제는 암세포를 죽이는데 외부 물질이 아닌 환자 몸 속의 면역세포를 이용한다는 점에서 기존 항암제와 차별점이 있다.
구체적으로 환자의 면역세포를 꺼내 활성화∙증식 또는 유전자 재조합 기술을 통해 암세포 특이적으로 싸울 수 있도록 조작 후 다시 넣어주는 방식이다. 약물로 인한 부작용은 최소로 하면서 공격력은 극대화한 것이다.
그중 CAR-T를 이용한 치료제는 글로벌 임상만 100여건에 이를 정도로 많다. 몸 속 면역계에는 수지상 세포, 자연살해세포, T세포 등 다양한 면역세포가 존재하는데 유독 CAR-T가 이렇게 뜨거운 관심을 받는 이유는 무엇일까?
◇CAR-T, 그 탄생 배경
기존 T세포 이용 치료제는 T세포 수용체(T cell receptor, TCR)가 특정 암세포가 가진 항원을 표적으로 갖도록 조작해 암세포를 공격한다. TCR은 MHC(Major histocompatibility complex)라는 분자를 통해 암 세포 항원을 인식한다. 이때 MHC는 전세계 60억 인구가 각각 다른 특정한 조합을 갖고 있어, TCR이 항원을 인식하기 위해선 마치 ‘스마트폰의 지문인식 기능’처럼 MHC 분자와 딱 들어맞아야 한다. 이러한 정교한 T세포의 항원 인식 방식 때문에 TCR을 조작할 때 MHC와의 상호작용을 늘 염두해야 하고 TCR-T세포 치료제는 환자 맞춤형 제작이 필연적이다.
이 문제를 개선한 것이 CAR-T로 암세포의 항원을 인식하는 수용체를 따로 넣어주는 기술이다. 암세포 항원을 CAR가 직접 인식하기에 MHC type과는 무관하게 공격을 가할 수 있어 적용 가능한 환자군이 넓어진다. 또한 CAR에 T세포를 활성화시키는 보조인자를 부착해 암세포 살상 능력을 올릴 수 있으며 ‘살아있는 약물’로서 체내에 더 오래 머무를 수 있게 했다.
프랑스 바이오 회사인 셀렉티스(Cellectis)는 더 나아가 유전자 가위로 TCR를 제거해 건강한 타인의 CAR-T를 환자에 주입하는 치료 방법을 개발 중이다.
◇삼대에 걸친 변천사, 더 빠르게 그리고 더 특이적으로
1989년, CAR-T 1세대가 Dr. Zelig Eshhar와 동료들에 의해 처음 만들어졌지만 이후 20여 년이 지나도록 CAR-T는 임상적으로 성공하지 못했다. 가장 큰 이유는 CAR-T의 항원에 대한 반응성이 미미했기 때문이다.
이후 2세대는 특이적으로 악성 B세포 CD19를 인식하는 항체가 추가됐고 자극 도메인을 통해 T세포 반응을 증폭하는 방향으로 보완됐다. 그 결과 몸속에 약 천 배가 넘는 CAR-T가 증식했다.
3세대에는 보조자극 도메인이 두개로 추가됐고 적은 수의 CAR-T를 투여에도 효율적으로 세포 증식이 가능해졌고 체내 지속시간이 길어졌다. 또한 ‘암세포 특이적 인식 능력’을 향상시켜 정상세포를 공격하는 부작용을 최소화했다. 삼대에 걸쳐 암세포에 특이적으로, 빠르게 그리고 효과적으로 공격할 수 있도록 보완된 것이다.

▲암세포를 공격하는 CAR-T(세대별 비교)항원결합 도메인(scFvs, Single-chain variable fragments): 암세포 항원에 특이적으로 결합필수 신호전달 도메인(CD3ζ): 항원 인식 후 T세포 자가 증식을 유도보조자극 도메인: 신호전달을 증폭, 결과적으로 T세포 자가 증식을 증가시키는 역할
◇CD19 타깃 CAR-T, 악성 혈액암에서 효과 탁월
CAR-T 치료제가 모든 암치료제에 효과가 탁월한 것은 아니다. 특히 유방암, 폐암 등과 같은 고형암(Solid cancer)에서는 종양 조직이 분비하는 T세포 활성저하 인자 등을 포함한 면역억제 미세환경(immunosuppresive microenvironment)으로 인해 CAR-T의 효율이 낮은 것으로 알려져 있다.
CAR-T가 치료제로써 주목을 받은 것은 2011년 펜실베니아대학 Carl June 교수팀이 진행한 임상 결과로 CD19 항원을 인지하는 2세대 CAR-T를 3명의 말기 만성림프구성백혈병 환자에게 주사했더니 2명에서 완치 효과가 10개월 동안 지속되는 것이 보고됐다. '연쇄살인마' 혹은 '살아있는 약물'이라는 별명을 얻게 된 것도 이때다.
이후 CAR-T 치료제는 다른 면역세포치료제와 달리 백혈병을 포함한 혈액암에서 효과가 있다는 연구 결과가 잇따라 발표됐고 현재 이 적응질환에서 임상시험이 활발히 진행 중이다. 주 표적 대상인 항원 CD19, CD20은 급성 림프구성 백혈병 환자의 백혈병 세포에서 과다 발현하고 있다고 알려져 있다. 특히 이 환자군에서 CAR-T가 탁월한 이유는 골수 이식을 받았지만 재발한 경우나 기존 항암제 리툭산(Rituxan)이 더 이상 듣지 않는 환자에서 탁월한 효과를 나타낸다고 보고됐기 때문이다.
면역세포항암제 분야에서 CAR-T 치료제는 혈액암 환자에서 굉장히 획기적인 효과를 보이지만 적응증이 국한적이라는 평가를 받고 있다.
◇CAR-T, 아직 해결해야 할 문제들…그리고 대안
CAR-T를 치료제로 쓰기엔 아직 보완되야 될 부분이 있다. 임상적으로 가장 큰 문제점은 보조자극이 추가됨에 따라 생기는 면역 과다활성이다. 사이토카인 신드롬(Cytokine syndrome)으로 불리는 이 부작용은 T세포가 면역 활성물질을 과다하게 분비함에 따라 일부 환자에게서 고열, 근육통, 낮은 혈압과 호흡이 나타났으며 주노(Juno Therapeutic)의 초기 임상실험에서 두 명의 환자가 사망했다. 이를 극복하기 위해 사이토카인 억제제를 병용 투여하는 방식을 사용하고 있다.
그외 CD19를 발현하는 정상 B세포를 공격한다는 단점이 있다. 실제 2014년 주노가 진행한 임상시험에서 면역활성 물질인 인터루킨-6(Interleukin-6, IL-6)가 높은 상태로 지속돼 환자가 사망하면서 임상시험이 잠시 중단되기도 했다.
최근 주노의 후보물질 급성 림프구성 백혈병 치료제 JCAR015 임상시험에서도 CAR-T 활성을 증가시키기 위해 플루다라빈(fludarabine)을 전처치(preconditioning) 요법을 사용하다 2명의 환자가 사망해 FDA 임상시험이 보류되기도 했다. 다른 전처치 항암제인 싸이클로포스파미드를 단독 전처치 요법으로 사용하는 전제하에 임상 재개됐다.
CAR-T 치료법의 획기적인 치료효과에도 불구하고 부작용들이 발견되자 여러 연구팀에서 이에 대한 대안을 제시하고 있다. CAR-T가 정상 B세포를 공격하는 것을 방지하고자 주노 Michel Sadelain 박사는 CAR-T가 정상 세포와 만날 경우에만 억제되는 수용체를 도입해 ‘암세포만 공격하는 CAR’를 고안했다.

▲출처:주노사
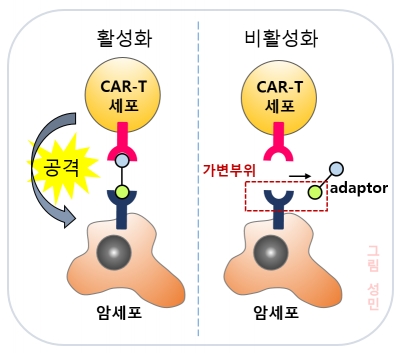
퍼듀대학교(Perdue university) 이용구 연구팀은 CAR-T가 하나의 항원만 표적하는 한계점을 극복하기 위해 adaptor 분자를 만들었다. 이 유기분자는 한 쪽은 CAR에 연결되고 다른 한쪽은 암세포에 연결돼 암세포 항원의 종류에 따라 adaptor를 조작하면 다양한 암세포 항원을 인식해 공격할 수 있다. 또한, 이 adaptor는 혈액 내에서 20분 정도를 머문 후 분해되기 때문에 과다한 사이토카인 생성으로 인한 부작용을 극복할 수 있다는 장점이 있다.
지난달 21일 미국국립보건원(NIH)은 칼 준(Carl June) 연구팀이 유전자 가위로 불리는 CRISPR를 이용해 'CAR'를 T세포에 도입한 CAR-T를 만성림프성 백혈병환자에게 주입하는 임상을 승인한 바 있다. 이처럼 유전자 가위라는 기술 혁신으로 CAR를 T세포로 도입하기가 한결 간편해졌다.
황유경 녹십자랩셀 연구소장은 이에 대해 "유전자 가위는 원하는 유전자를 넣고 뺄 수 있기 때문에 CAR를 세포 안에 삽입하기에 분명 혁신적인 기술"이라면서도 "종양 환자한테는 이익이 더 크기 때문에 임상이 진행되고 있지만 CRISPR를 인간에게 사용하는 것이 안전한가는 아직 밝혀진바 없다"라고 말했다.



















