BioS+
-
바이엘, 비비디온 '주요 에셋' STAT3 저해제 "개발중단"
박희원 기자 2025-11-17 10:24
-
질랜드, 'GLP-1/2' 추가 개발 "보류"..차별성 부족
박희원 기자 2025-11-17 08:47
-
데이원, 머사나 2.85억弗 인수.."B7-H4 ADC 개발"
이주연 기자 2025-11-17 07:01
-
FNCT, 新타깃 ‘CSF3 항체’ IPF 전임상 “논문 게재”
신창민 기자 2025-11-14 10:55
-
FDA, 신임 CDER 소장에 "26년 베테랑" 항암제 책임자
김성민 기자 2025-11-14 09:58
-
룬드벡, 에이프릴 'CD40L 저해제' 1b상서 "PoC 확인"
김성민 기자 2025-11-14 07:10
-
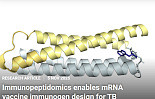
MIT 연구팀, ‘결핵백신’ 100년만에 “新타깃 발견”
이주연 기자 2025-11-13 12:18
-
릴리, 사네진과 '대사질환 RNAi' 개발 "12억弗 딜"
박희원 기자 2025-11-13 11:13
-
로슈, '경구 BTK저해제' MS 3상 2건 ‘1차종결점 달성”
이주연 기자 2025-11-13 09:44
-
HLB 엘레바, 'FGFR2 저해제' 왜 인수? 확장성은?
베를린(독일)=김성민 기자 2025-11-13 06:39
-
지놈앤컴퍼니, ‘마이크로바이옴’ 위암 2상 “최종 결과”
신창민 기자 2025-11-12 15:15
-
머크, ‘경구' PCSK9 고지혈증 3상 "LDL-C 56%↓"
박희원 기자 2025-11-12 13:58
-
‘난항 속’ 라이엘, 中서 대장암 ‘GCC CAR-T’ 사들여
신창민 기자 2025-11-12 10:14
-
길리어드, ‘트로델비’ 유방암 3상 “PFS 실패”..또 타격
신창민 기자 2025-11-12 09:06
-
릴리, 메이라 '초희귀 안구질환' AAV 4.75억弗 L/I
이주연 기자 2025-11-12 06:54
-
AZ, ‘비만 근육보존' 식스픽스 1.7억弗 "인수옵션 행사"
박희원 기자 2025-11-11 14:24

























![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2277741.jpg)

![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/74/74/2277741.jpg)