오피니언
제넥신, 'DNA백신+키트루다' 자궁경부암 2상 ORR 42.3%
바이오스펙테이터 장종원 기자
AACR서 2상 26명 중간분석결과 발표..PD-L1 발현율 1% 이상 ORR은 50%, HPV16 환자군은 47.4%..DCR은 57.7%

제넥신이 자궁경부암 환자 치료를 위한 DNA백신 'GX-188E'와 면역관문억제제 '키트루다'의 병용 임상 2상 중간 결과를 공개했다. DNA백신과 면역관문억제제 조합은 키트루다 단독 투여시 12.2%에 불과했던 객관적 반응률(objective response rate, ORR)을 42.3%까지 끌어올리는 긍정적인 결과를 냈다. 특히 PD-L1 발현율이 1% 이상인 환자군으로 좁히면 ORR은 50%까지 증가하는 것으로 나타났다.
우정원 제넥신 부사장은 27일(현지시간) 미국 암연구학회 온라인학술대회(AACR VIRTUAL ANNUAL MEETING I)의 면역항암제 임상연구세션(Immunotherapy Clinical Trials 1)에서 제넥신과 미국 머크가 공동으로 진행하는 자궁경부암 병용 2상 중간결과를 발표했다(NCT03444376).
이번 연구는 외과적 수술이나 방사선치료, 항암화학요법 등 표준치료에 실패한 진행성 자궁경부암 환자(HPV 16형 or 18형)에게 키트루다(3회)와 GX-188E(7회)를 병용 투여함으로써 객관적 반응률(ORR), 질병 통제율(DCR) 등을 높일 수 있을지를 평가하는데 있다. 2018년 자궁경부암 2차 치료제로 허가받은 키트루다는 ORR이 12.2%(PD-L1 발현율이 1% 이상인 환자는 14.3%)에 불과한데다 PD-L1 음성 환자는 전혀 반응하지 않아 대안이 필요했다.
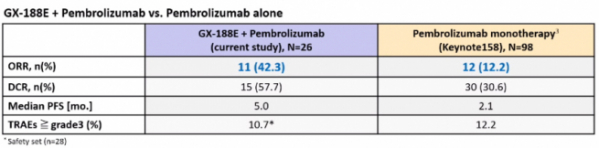
제넥신은 26명의 환자를 분석한 결과 11명의 환자에서 완전관해(CR) 4명(15.4%)과 부분관해(PR) 7명(26.7%)을 확인해 ORR은 42.3%로 나타났다. 종양이 더이상 자라지 않는 안정형병변(SD) 환자(4명)까지 포함한 질병통제율(DCR)은 57.7%(15/26)에 이르는 것으로 나타났다. 무진행생존기간(PFS)은 5개월(중앙값)로 집계됐다.
특히 PD-L1 발현율 1% 이상으로 환자군을 좁히면 ORR은 50%(10/20), HPV16 환자군은 47.4%, 편평상피세포암(squamous cell carcinoma) 환자는 45%로 높은 반응률을 나타냈다. 우 부사장은 "PD-L1 음성 환자에게도 2건의 종양 감소효과가 관찰됐으며 hpv18 및 선암(Adenocarcinoma) 환자에게도 반응이 나타났다"고 소개했다.

또한 23명을 대상으로 한 분석에서 78.3%에 해당하는 18명에서 HPV 항원에 특이적인 T세포(HPV-specific T cell) 반응이 나타났다. GX-188E와 키트루다 병용투여군의 안전성과 관련해서는 10.7%가 3~4 등급의 이상반응을 경험했는데 이는 키트루다 단독 투여(12.2%)와 유사한 수준으로 나타났다.
우 부사장은 "이번 임상을 통해 GX-188E와 키트루다의 병용은 항종양 효과를 통해 표준치료에 실패한 전이성 혹은 재발성 자궁경부암 환자에게 안전하고 효과적인 치료법이 될 수 있음을 확인했다"고 강조했다.
제넥신은 올해 GX-188E, 키트루다 병용 2상을 마무리하고 2021년 조건부 품목허가를 신청할 계획이다.







![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/74/74/2071974.jpg)







![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2071974.jpg)


