국제
화이자, DMD 소아 1b상 "효능, (조절가능)안전성 확인"
바이오스펙테이터 봉나은 기자
"2Q 임상3상 개시 예정"

화이자는 15일(현지시간) 뒤센 근위축증(DMD) 소아 환자를 대상으로 유전자 치료제 후보물질 ‘PF-06939926’의 안전성 및 내약성을 평가하기 위해 진행한 임상1b상(NCT03362502)의 예비결과를 발표했다. 임상적 효능 개선 및 조절가능한 안전성을 확인했다는 결과다.
이번 결과는 6세 이상 12세 이하(평균 8세) DMD 남아 환자 9명의 치료 12개월차 데이터를 분석한 임상 결과다. 화이자는 지난해 처음 발표한 환자 6명 및 추가 환자 3명의 업데이트 결과를 5월12일부터 15일까지 온라인으로 개최된 미국 유전자치료학회(ASGCT) 연례회의에서 구두로 발표했다.
DMD는 근육막의 안정성 및 기능 유지에 필요한 디스트로핀 단백질을 암호화하는 유전자에 변이가 생겨 주로 남아에게 발생하는 유전성 근육질환이다. DMD 환자는 시간이 지남에 따라 점차적으로 근육 변성이 악화돼 10대 초반에 휠체어의 도움을 받아야 하는 상황에 이르며, 20대 후반에는 사망에 이를 수도 있다.
이에 화이자는 근육 특이적 프로모터의 조절하에 인간 디스트로핀 유전자(미니 디스트로핀)를 전달하는 재조합 AAV9 캡시드 약물로 ‘PF-06939926’을 개발하고 있다.
화이자는 2018년부터 임상1b상을 진행해왔다. DMD 남아 환자 6명에 대한 초기 결과는 지난해 6월 개최된 제25회 근이영양증 보호자단체(PPMD) 연례 커넥트 컨퍼런스에서를 처음 발표한 바 있다. 당시 화이자는 PF-06939926(1E14 vg/kg 또는 3E14 vg/kg)을 1회 정맥 투여받은 DMD 남아 환자 6명 중 고용량 투여군에서 근섬유 수치가 임상적으로 유의미하게 개선된 결과를 확인했다고 발표했다. 그러나 6명 중 1명이 심각한 이상반응으로 보체 시스템 활성화 관련 급성 항체반응을 보여 급성 신장손상, 용혈반응, 혈소판 수 감소 반응이 나타났다. 환자는 즉시 소아 중환자실에 입원해 혈액투석과 보체 억제제를 처방받았으며, 11일 후 병원에서 퇴원하고 15일 이내 신장 기능이 정상으로 회복된 것으로 확인됐다. 이에 화이자는 추가 환자에 대한 투약을 재개할 수 있도록 계속해서 안전성 모니터링 작업을 진행하고 있다고 밝혔다.
이번에 새로 공개된 추가 3명은 PF-06939926 3E14 vg/kg을 1회 정맥투여받았다.
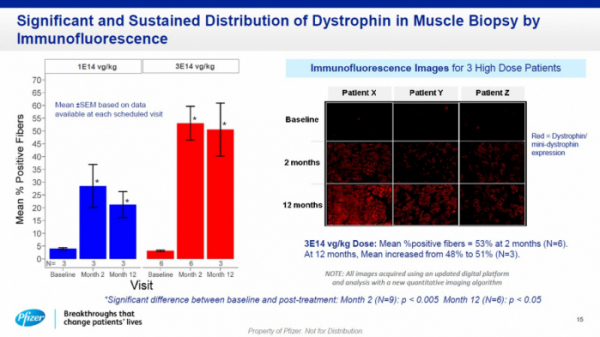
화이자는 임상의 1차 종결점으로 안전성 및 내약성을 평가하고, 2차 종결점으로 미니 디스트로핀 발현 및 근섬유 내 분포를 확인했다. 그 결과, 임상에서 PF-06939926는 잘 통제됐으며 임상적 효능 및 조절 가능한 안전성을 확인했다고 설명했다.
PF-06939926 치료군은 치료 12개월차까지 미니 디스트로핀 발현 수치가 유지되고 DMD 환자의 기능적 운동능력을 평가하는 평가 척도(North Star Ambulatory Assessment, NSAA) 수치가 개선된 것으로 확인됐다. 특히 고용량 투여군은 근섬유 내 디스트로핀 발현 수치가 치료 2개월차에 평균 53%(6명), 치료 12개월차에 평균 48~51%(3명)인 것으로 관찰됐다. NSAA 수치는 고용량 투여군이 위약군(외부 데이터 기준) 대비 6점이상 높았다.
▲미국 ASGCT 발표 결과
다만 환자 40% 이상에서 이상반응이 관찰됐으며 가장 빈번한 이상반응으로 구토, 메스꺼움, 식욕저하, 발열이 확인됐다. 심각한 이상반응은 치료 14일차에 3건(탈수로 인한 구토, 급성 신장 손상, 혈소판 감소증)이 관찰됐으며 이들은 항구토제, 수액, 혈액투석, 혈소판 수혈 등을 처방받아 2주 이내 치료됐다고 설명했다.
한편, 화이자는 DMD 환자 99명을 대상으로 PF-06939926의 안전성 및 효능을 평가하는 임상3상(NCT04281485)도 개시를 앞두고 있다. 화이자는 이번 예비결과가 pivotal 임상3상을 뒷받침할 수 있을 것으로 기대했다.
Seng Cheng 화이자 희귀질환 연구부문 최고과학담당자(CSO)는 “이번 임상에서 확인된 예비 효능 데이터 및 조절 가능한 안전성 결과를 토대로 DMD 남아 환자를 위한 혁신적인 치료제로 개발할 수 있을 것으로 기대한다”며, “계획보다 빠르게 임상3상에 진입해 올해 2분기 내 환자 투약을 개시할 계획”이라고 말했다.

















