국제
비엘라, 시신경척수염 치료제 '업리즈나' FDA 승인
바이오스펙테이터 서윤석 기자
항-AQP4 항체 양성 시신경척수염(NMOSD) 치료제 ‘업리즈나’..알렉시온 '솔리리스'에 이은 2번째 FDA 승인 약물..업리즈나 6월 출시예정

비엘라바이오(Viela Bio)의 '업리즈나(Uplizna, inebilizumab-cdon)'가 시신경척수염(NMOSD) 치료제로 미국 식품의약국(FDA)의 승인을 받았다. 업리즈나가 시판되면 알렉시온(Alexion Pharmaceuticals)의 '솔리리스(Soliris)'와 경쟁하게 된다.
시신경척수염(neuromyelitis optica spectrum disorder, NMOSD)은 중추 신경계에 나타나는 자가면역질환의 일종으로 시력손상, 안구통증 증상을 보이며 무감각증, 쇠약감, 방광 및 장기능 장애등이 수반된다. 미국 국립보건연구원(NIH)은 미국에서 약 4000~8000명이 NMOSD를 앓고 있는 것으로 추정했다.
시신경척수염(NMOSD)으로 진단된 환자의 약 80%가 AQP4(aquaporin-4)에 결합하는 항체에 대해 양성반응을 나타내는데, 이 항-AQP4 항체는 CD19 양성 B세포에서 생성돼 중추신경계의 성상세포에 결합함으로써 질병을 유발한다. 지난해 6월, 알렉시온의 솔리리스를 FDA가 항-AQP4 항체 양성 시신경척수염 환자를 대상으로 첫 승인하기 전까지 치료제가 없는 상황이었다.
비엘라는 11일(현지시간) 미국 FDA에서 AQP4 항체 양성 시신경척수염(NMOSD)을 가진 성인을 대상으로 CD19 항체 업리즈나(Uplizna, invilizumab-don)를 승인했다고 밝혔다. 비엘라는 업리즈나를 오는 6월에 출시할 예정이다. 비엘라는 2018년 아스트라제네카의 자회사 메드이뮨(Medimmune)에서 스핀오프한 회사다.
브루스 크리(Bruce Cree) 캐리포니아대 교수이자 N-Momentom 임상연구원은 "시신경척수염은 치료하기 어려운 질병으로 환자는 마비와 실명같은 영구적 장애를 얻을 수 있다"며 "업리즈나는 임상에서 재발 위험도와 입원률을 줄였다"고 말했다. 이어 "검증된 효능과 안전성, 1년에 2회 투여하는 유지용량(maintenance dose schedule)을 나타낸 업리즈나는 의사와 시신경척수염 환자에게 새로운 치료옵션이 될 것"이라고 덧붙였다.
이번 업리즈나의 FDA 승인은 임상 2/3상(N-MOmentum, NCT02200770)의 결과가 바탕이 됐다. 비엘라는 230명의 시신경척수염(NMOSD) 환자에서 항-AQP4 항체 양성환자 213명을 선별해 위약군 52명, 업리즈나 투여군 161명으로 나눠 임상을 진행했다. 그 결과 업리즈나 투여군에서 질병의 위험도를 77% 감소시키며 1차 종결점을 충족시켰다. 또, 업리즈나 투여군의 89%는 위약군 58%와 비교해 치료 후 6개월간 질병의 재발하지 않았다. 비엘라는 업리즈나를 투여한 시신경척수염 환자에서 입원률이 통계적으로 유의미하게 감소하며 2차 종결점을 충족시켰다고 밝혔다.
가장 흔하게 나타난 이상반응은 요로감염 20%, 비인두염 13%, 주입반응(infusion reaction) 12%, 관절통(arthralgia) 11% 등이었다.
빌리 던(Billy Duun) FDA 약물평가연구센터(CDER) 국장은 "최근까지 시신경척수염 환자들에게 승인받은 치료옵션이 없었다"며 "업리즈나는 두번째로 승인된 치료제로 NMOSD 환자들에게 사용될 것"이라고 말했다.
빙 야오(Bing Yao) 비엘라 CEO는 "우리의 첫 승인받은 약물이 신경염증성 질환인 시신경척수염환자를 도울 수 있다는 것을 자랑스럽게 생각한다"고 말했다.
한편, 현재까지 NMOSD를 대상으로 승인받은 약물은 알렉시온의 솔리리스와 비엘라의 업리즈나가 있다. 추가로 로슈의 IL-6 저해제 '사트랄리주맙(satralizumab)'이 지난해 신약허가신청서를 제출한 상황이다. 이벨류에이트파마(EvaluatePharma)는 2026년에 솔리리스는 4억8800만달러, 업리즈나는 5억8600만달러, 사트랄리주맙은 4억3100만달러의 매출을 예상했다.
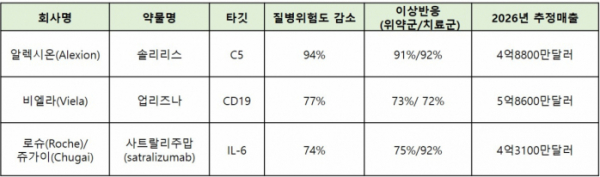
▲시신경척수염(NMOSD) 약물 2026년 예상 매출(이벨류에이트파마참조, 바이오스펙테이터 재구성)

















