기업
삼성바이오, '에이빈시오' 유럽 5번째 시밀러 '허가예고'
바이오스펙테이터 장종원 기자
약 3년만에 새로운 바이오시밀러 라인업 '추가'..암젠, 화이자와 경쟁할 듯..SB11, SB12, SB15 등 후속 파이프라인도 순항중

삼성바이오에피스가 유럽의약품청 약물사용자문위원회의 에이빈시오(SB8) 판매승인 권고로 유럽에서 약 2년 6개월여만에 새로운 허가 바이오시밀러 파이프라인 확보를 눈앞에 두게 됐다. 이를 통해 삼성바이오에피스는 바이오시밀러 경쟁이 치열한 유럽 시장에서 성장을 이어갈 새로운 동력을 얻게 됐다.
28일 업계에 따르면 삼성바이오에피스는 지금까지 자가면역질환 치료제 3종과 항암 바이오시밀러 1종을 허가받아 유럽과 미국 등에서 판매하고 있다.
특히 유럽에서는 베네팔리(엔브렐 바이오시밀러), `임랄디(휴미라 바이오시밀러), `플릭사비(레미케이드 바이오시밀러)와 온트루잔트`(허셉틴 바이오시밀러)를 판매하고 있다. 가장 최근에 허가받은 제품은 온트루잔트로 2017년 11월이다.
에이빈시오(아바스틴 바이오시밀러)가 최종 허가를 획득하면 삼성바이오에피스가 유럽에서 선보이는 다섯번째 바이오시밀러이자 두번째 항암 바이오시밀러가 된다. 햇수로는 3년여만에 새로운 상업제품을 확보하게 되는 셈이다.
앞서 허가받은 암젠/앨러간의 '엠바시'와 화이자의 '자이라베브'가 특허 문제로 아직 출시되지 않았다는 점에서 에이빈시오도 초기 경쟁력을 확보할 수 있을 전망이다. 에이빈시오의 마케팅 파트너사는 미국 머크(MSD)다.
에이빈시오의 오리지널 제품인 아바스틴은 지난해 글로벌 시장에서 총 70억7300만스위스프랑(약 8조9600억원)의 매출을 기록했으며 유럽 시장 매출은 17억9400만스위스프랑(약 2조2700억원)에 달한다.
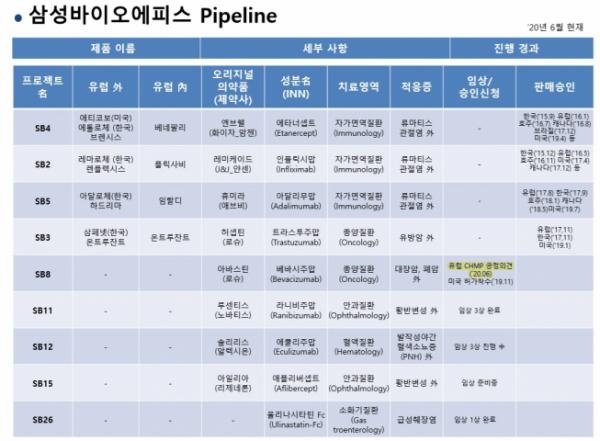
삼성바이오에피스의 미국 허가 파이프라인은 에티코보(베네팔리 바이오시밀러), 렌플렉시스(레미케이트 바이오시밀러), 하드리마(휴미라 바이오시밀러, 미출시), 온트루잔트(허셉틴 바이오시밀러)다. 가장 최근에 허가받은 제품은 하드리마(2019년 7월)다. 삼성바이오에피스는 지난해 11월 미국 식품의약국(FDA)에 에이빈시오의 판매허가 신청서(BLA)를 제출했으며 현재 심사가 진행중이다.
삼성바이오에피스는 이외에도 황반변성 치료제 SB11(루센티스 바이오시밀러)의 글로벌 3상을 완료했으며 또다른 황반변성 치료제 SB15(아일리아 바이오시밀러)는 3상을 승인받아 하반기 임상에 진입할 계획이다. 또한 SB12(솔리리스 바이오시밀러)는 임상 3상을 진행하고 있다.
삼성바이오에피스 첫 신약후보물질인 급성췌장염 치료제 SB26(울리나시타틴 Fc)은 현재 임상 1상을 완료했다.













![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2277741.jpg)



