국제
릴리, 코로나19 중화항체 단일요법 "FDA EUA 신청"
바이오스펙테이터 서윤석 기자
코로나19 중화항체 ‘LY-CoV555+LY-CoV016’ 병용요법 결과도 공개..경도~중등도 코로나19 환자서 1, 2차 종결점 충족

일라이 릴리(Eli Lilly)가 코로나19 중화항체 'LY-CoV555(bamlanivimab)' 단일요법(monotherapy)에 대해 미국 식품의약국(FDA)에 긴급사용승인(EUA)을 요청했다. 'LY-CoV555(bamlanivimab)+LY-CoV016(etesevimab)' 병용요법에 대한 긴급사용승인은 오는 11월에 신청할 예정이다.
릴리의 LY-CoV555는 앱셀러라(AbCellera)와, LY-CoV016는 준시(Junshi Biosciences)와 개발한 코로나19 중화항체다. 두 항체는 신종 코로나바이러스(SARS-CoV-2) 스파이크 단백질의 서로 다른 부위를 타깃하고 있다.
Daniel Skovronsky 릴리 최고책임자는 “지금까지 확인한 코로나19 항체 치료제 후보물질의 데이터가 단일요법과 병용요법으로 사용시 코로나19 환자를 치료하는 데 효과적일 수 있는 증거를 보여준다고 믿는다”며 “이런 치료요법을 신속히 이용할 수 있도록 전세계 규제기관과 협력하고 있다”고 말했다.
릴리는 7일(현지시간) 경도에서 중등도 코로나19 환자에 대한 LY-CoV555 단일요법을 FDA에 긴급사용승인(EUA) 신청했다고 밝혔다. 또, 코로나19 항체 치료제 후보물질 ‘LY-CoV555+LY-CoV016’ 병용요법 중간분석(interim anaylsis) 결과를 공개했다.
발표에 따르면 ‘LY-CoV555+LY-CoV016’ 병용요법은 치료받은 환자들이 바이러스 양, 증상, 입원 및 응급실 방문비율을 감소시켰다. 릴리는 ‘LY-CoV555+LY-CoV016’병용요법으로 치료받은 코로나19 환자군 112명과 위약군 156명을 비교해 임상을 진행했다. 각각의 항체는 2800mg을 투여했으며, 약물 농도는 이전에 발표한 임상 결과에서 유의한 효과를 본 농도다.
그 결과, ‘LY-CoV555+LY-CoV016’ 병용요법은 치료 11일차에 바이러스양을 유의미하게 감소시키며 1차 종결점을 충족시켰다(p=0.011). 특히, LY-CoV555 단일요법과 비교해 병용요법은 치료 3일차, 7일차에도 유의미하게 바이러스 양을 감소시켰다. 또, 7일차 분석에서 지속적으로 높은 바이러스 양(log(virus load)≥5.27)을 가진 환자비율은 병용요법군에서 3%(vs 20.8%)로 위약군보다 유의미하게 낮았다(p<0.0001).
또, ‘LY-CoV555+LY-CoV016’ 병용요법은 치료받은 후 28일내에 다시 병원에 입원하거나 응급실로 찾아온 비율은 0.9%(1/112명)으로 위약군 5.8%(9/156명)보다 낮아 2차 종결점을 충족시켰다(p=0.049). 특히, 65세 이상 또는 BMI35 이상의 고위험군 환자에서는 병용요법이 0%(0/31명)로 위약군 13.5%(7/52명)보다 낮았다. 임상증상변화(symptom score change)도 병용요법에서 유의미한 개선을 나타냈다(p=0.009).
릴리는 추가 데이터 분석 후 오는 11월 ‘LY-CoV555+LY-CoV016’ 병용요법에 대한 긴급사용승인(EUA)을 FDA에 요청할 예정이라고 밝혔다. 병용요법에 대한 신약허가신청(BLA)는 내년 2분기로 예상하고 있다.
한편, 릴리는 경도에서 중등도 코로나19 환자를 대상으로 700mg, 2800mg, 7000mg 용량을 사용한 LY-CoV555 단일요법 임상에서 중간용량인 2800mg 투여군만 1차 종결점을 충족시킨 결과를 보인바 있다.
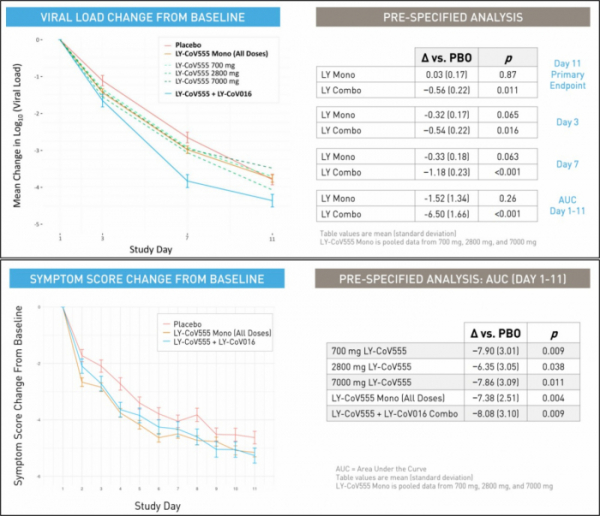
▲LY-CoV555+LY-CoV016 병용요법 임상 결과, 바이러스양 및 임상증상 변화(릴리 발표자료 참조)

















