국제
블루버드, SCD 유전자치료제 FDA '승인 거절'
바이오스펙테이터 윤소영 기자
겸상적혈구병(SCD) 치료제 후보물질 ‘LentiGlobin’ 상업용 벡터에 대한 동등성 비교 자료 요청..2022년 BLA 재제출 예정

블루버드(Bluebird bio)의 겸상적혈구병(sickle cell disease) 치료제 후보물질 ‘LentiGlobin™(bb1111)’이 미국 식품의약국(FDA)의 승인을 받지 못했다. 블루버드는 2022년 말까지 CMC(Chemistry, Manufacturing, Control) 부분을 보충해 BLA(Biologics License Application)를 다시 제출할 예정이다.
블루버드는 지난 4일(현지시간) 2020년 3분기 실적발표 자리에서 겸상적혈구병 치료제 후보물질 LentiGlobin™의 BLA 제출 결과에 대해 발표했다. LentiGlobin™은 블루버드가 개발한 유전자치료제이며, 유럽에서는 지난해 β-지중해성빈혈 치료제로 승인되어 ‘Zynteglo®’라는 이름으로 판매되고 있는 약물이다.
발표 내용에 따르면 블루버드는 HGB-206 임상 1/2상(NCT02140554) 그룹 C의 결과를 기반으로 한 BLA에서 약의 상업적 생산에서 현탁액 기반의 렌티바이러스 벡터(suspension-based Lentiviral Vector, sLVV) 사용에 대한 FDA의 동의를 얻어냈다. 하지만 FDA는 상업용 렌티바이러스 벡터로 제조한 약이 겸상적혈구 환자와 건강한 사람에서 같은 안전성 및 유효성을 나타내는지에 대한 완제의약품 비교(drug product comparability)자료를 요청했다.
이러한 FDA의 요청에 블루버드는 코로나19와 관련된 생산 계약이 겹쳐 2022년 말에 BLA를 제출할 수 있을 것이라고 설명했다.
겸상적혈구병(Sickle cell disease)는 헤모글로빈을 만드는 β-글로빈의 변이로 발생하는 유전질환이다. β-글로빈의 특정 염기서열에 변이가 생기면 산소와 결합하지 않은 헤모글로빈은 서로 붙어 낫모양(겸상)의 적혈구를 생성한다. 겸상적혈구는 혈관을 잘 통과하지 못해 혈류장애를 일으키고 쉽게 파괴되어 빈혈을 유발한다. 겸상적혈구병이 1년에 얼마나 혈관폐쇄위기(vaso-occlusive crises, VOCs)를 유발하는지에 따라 기대수명이 달라진다.
블루버드는 지난 6월 겸상적혈구병 환자를 대상으로 한 LentiGlobin 임상 1/2상 중간결과를 발표했다. 블루버드는 LentiGlobin치료를 받은 그룹 C 환자(25명) 모두 헤모글로빈 수치가 높아졌으며 정기적인 수혈을 중단할 수 있게 되었다고 밝혔다.
결과 발표에 따르면 임상에 참여한 16명의 환자를 6개월 이상 추적관찰한 결과, 치료로 만들어진 항-겸상적혈구(anti-sickle hemoglobin) ‘HbAT87Q’의 중간값이 전체 헤모글로빈의 40% 이상으로 유지되었다. 또한 혈관폐쇄위기(vaso-occlusive crises, VOCs)와 급성흉부증후군(acute chest syndrome, ACS)이 나타났던 14명의 환자에게서 연간 발생이 99.5% 감소했다.
한편, 블루버드는 이번 실적발표를 통해 2021년 중반까지 β-지중해성빈혈 치료제 후보물질(HGB-207, HGB-212)에 대한 BLA 제출을 완료할 것이라고 밝혔다. 또한 BMS와 공동개발중인 다발성골수종 CAR-T 치료제 ‘bb2121’ BLA에 대해 FDA가 우선심사를 진행하고 있으며 내년 3월 27일까지 시판허가 결정이 난다고 밝혔다.
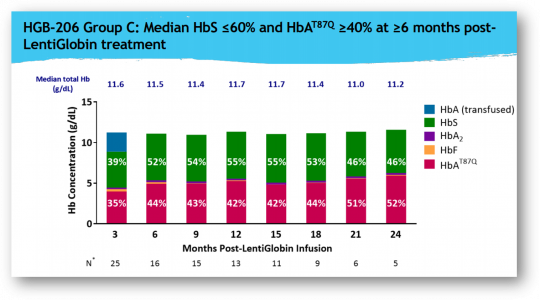
▲LentiGlobin임상 1/2상 자료(블루버드 발표자료 참조)














![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2071974.jpg)
