국제
앨라일람, ’첫’ PH1 치료제 '옥슬루모' FDA도 승인
바이오스펙테이터 서윤석 기자
유럽에 이어 승인..1년 평균 약가 49만3000달러 책정..미국서 연말 시판 예정
앨라일람(Alnylam Pharmaceuticals)이 원발성옥살산뇨증(PH1) RNAi 치료제 ‘옥슬루모(Oxlumo, lumasiran)’에 대해 유럽에 이어 미국에서 승인받았다. 옥슬루모는 현재까지 원발성옥살산뇨증(PH1)에 승인된 유일한 치료제다.
이로써 앨라일람은 ‘온파트로(Onpattro, patisiran)’, ‘기브라리(Givlaari, givosiran)’에 이어 3번째 RNAi 치료제를 승인받았다.
앨라일람은 24일(현지시간) 미국 식품의약국(FDA)에서 원발성옥살산뇨증(PH1) RNAi 치료제인 ‘옥슬루모’를 승인했다고 밝혔다. 옥슬루모의 1년 약가는 평균 약 49만3000달러로 책정됐으며 미국서 연말에 공급될 예정이다.
앨라일람은 장기이식을 받지 않은 원발성옥살산뇨증(PH1) 환자가 미국과 유럽에서 1000~1700명 정도 있을 것으로 예상하고 있다.
원발성옥살산뇨증(PH1)은 간에서 옥살레이트(oxalate)의 과도한 생성으로 인해 발병하는 희귀질환이다. 신장과 요로에 옥살산 결정 또는 옥살산 칼슘 결정이 침착하게 되며, 병이 진행되면서 신장 손상으로 인해 신장 투석을 해야 하고, 결국에는 간이식이나 신장이식을 하게 된다.
현재까지 원발성옥살산뇨증(PH1) 환자를 대상으로 승인받은 치료제는 없으며, 이뇨제를 사용해 칼슘 배출을 증가시키거나 식이조절을 통해 옥살산 섭취를 줄이는 등의 관리법만 있는 상황이었다.
옥슬루모는 옥살레이트를 생성하는 효소인 GO(glycolate oxidase)를 암호화하는 HAO1(hydroxyacid oxidase 1)을 타깃하는 RNAi 치료제다. HAO1을 저해해 GO의 생성을 줄여 옥살레이트를 감소시키는 기전이다.
Kim Hollander OHF(Oxalosis and Hyperoxaluria Foundation)재단 이사는 “원발성옥살산뇨증(PH1)을 앓고 있는 환자들은 병의 진행에 대한 불확실성, 집중투석(intensive dialysis)의 필요성, 신장 또는 간 이식이 필요할 것이라는 신체적/정서적 불안에 직면하게 된다”며 “옥슬루모의 승인은 환자들에게 새로운 치료옵션과 희망을 제공한다”고 말했다.
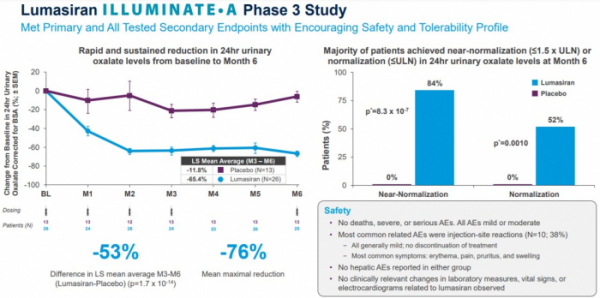
FDA의 이번 승인은 ILLUMINATE-A 임상 3상 연구를 기반으로 이뤄졌으며, ILLUMINATE-B 임상 3상 중간분석도 참고했다. 구체적으로, 앨라일람은 ILLUMINATE-A 임상 3상에서 6세이상의 원발성옥살산뇨증(PH1) 환자 39명을 대상으로 임상을 진행한 결과, 옥슬루모 투여군이 위약군 대비 소변 옥살레이트 수치를 65.4%(vs 1.8%, p=0.001) 감소시킨 것을 확인했다. 또, 옥슬루모를 투여받은 환자의 84%는 소변 옥살레이트 수치가 정상에 근접했으며, 52%는 정상범위로 회복됐다(p=0.001).
또, 앨라일람은 3개월에서 6세 미만의 영유아 18명을 대상으로 진행한 ILLUMINATE-B 임상 3상 중간분석에서, 옥슬루모 투여군의 소변 옥살레이트가 평균 72% 감소한 것을 확인했다.
Akshay Vaishnaw 앨라일람 사장은 “옥슬루모의 승인은 RNAi 치료제가 원발성옥살산뇨증(PH1) 같은 심각하고, 생존을 위협하는 질병을 치료할 수 있다는 것에 대한 증거”라며 “원발성옥살산뇨증 환자와 가족들에게 치료옵션으로 옥슬루모를 사용할 수 있게 된 역사적인 순간”이라고 덧붙였다.
한편, 경쟁사인 디서나(Dicerna Pharmaceuticals)는 지난 4월 원발성옥살산뇨증 RNAi 치료제 후보물질 ‘네도시란(nedosiran, DCR-PHXC)’의 긍정적인 임상 3상 결과를 발표했다. 네도시란은 젖산 발표효소(LDH)를 타깃해 옥살레이트의 생성을 막는 기전이다.