오피니언
[BioS 레터]'항암제 내성 극복' 대안, ‘오토파지 저해제’
전도용 엘베이스 대표
“안전하게 선택적으로 암에서 과활성화된 오토파지 억제할 수 있느냐가 성공의 관건”
암 치료가 어려운 수많은 이유들이 존재하지만, 아마도 가장 쉬운 대답은 “암의 생명력, 그리고 치료에 대한 암의 저항성(내성)”이 아닐까 싶다. 암 치료를 위한 약물 요법의 경우 1세대 화학항암제를 시작으로 2세대 표적항암제가 개발돼 현재까지 가장 많이 사용되고 있지만, 항암제 내성이라는 큰 문제에 직면해 있다. 그러나 화학항암제와 표적항암제와는 달리 면역력을 올려 치료하는 것으로 개발된 면역항암제에서는 위에서 언급한 약물 내성이 생기지 않을지도 모른다는 기대가 있었다. 하지만 미국 식품의약국(FDA)에서 승인된 면역항암제에서도 약물 내성이 생기기 시작하면서 이를 극복하기 위한 시도가 진행되고 있다.
바이오스펙테이터에서는 지난 9월 28일 Nature에 발표된 “오토파지, 암세포의 ‘면역회피’ 돕는다”는 내용의 논문을 소개한 바 있다. 해당 기사에서 다룬 것처럼, 항암 치료에 있어서 오토파지의 중요성은 이미 어느 정도 인식되어 왔으나, 이를 컨트롤 할 수 있는 명확한 방법은 아직 손에 쥐고 있지 않다. 그럼에도 불구하고 여전히 오토파지를 이용한 항암제 개발에 대한 연구가 활발히 진행되고 있으며, 이는 암 치료에 있어 가장 큰 숙제인 항암제 내성 극복에 중요한 Key가 될 것으로 기대된다.
오토파지란?
우리 몸은 약 60조 개의 세포로 구성되어 있으며 세포 안에서는 매일 활동에 필요한 에너지와 물질들이 생산되고 있다. 그 과정에서 기능이 저하된 세포소기관, 변형된 단백질, 세포질의 노폐물과 같은 쓰레기가 발생한다. 이러한 쓰레기가 세포 안에 계속 쌓이게 되면 세포는 점점 기능이 떨어지고 결국에는 죽고 만다. 따라서 세포 안에서 쓰레기를 치우고 재활용하는 시스템이 존재하게 되는데 그것이 바로 오토파지이다.

오토파지는 그리스어로 ‘스스로(auto), 먹는다(phagy)’는 뜻의 단어가 합쳐진 것으로 우리말로는 ‘자가포식’이라 부른다. 오토파지가 처음 세상에 알려진 것은 세포의 구조와 기능에 관한 연구로 노벨상을 수상한 벨기에 과학자 크리스티앙 드 뒤브(Christian du Duve)에 의해서다. 그는 1960년대에 미토콘드리아 등의 세포 소기관이 이중막으로 둘러싸인 것을 발견하고 이를 ‘오토파지 액포’라고 불렀다. 이후 오랫동안 연구가 진행되지 않다가 1992년 일본의 오스미 요시노리 교수(Yoshinori Ohsumi)가 단세포 생물인 효모 내부에서 이루어지는 오토파지 과정을 보고하였고, 이듬해 관련 유전자 15종을 발견하면서 오토파지가 생물이 살아가는데 중요한 역할을 한다는 사실이 밝혀졌다. 오스미 교수는 이 업적으로 2016년 노벨 생리의학상을 수상했다.

(Source: Nat Rev Cancer. 2017 17(9):528-542.)
오토파지의 기능이 제대로 작동되지 않아 노폐물이 쌓이게 되면 각종 질병의 단초가 된다. 단백질 찌꺼기가 넘쳐 세포 밖으로 나오게 되면 유전자 변이가 일어나 암을 유발할 수 있고, 뇌에 쌓이게 되면 알츠하이머 치매나 파킨슨병을 일으킬 수도 있다. 반면, 오토파지는 손상이 심각한 세포가 죽지않고 지속적인 생존이 가능하도록 도울 수 있는데, 예를 들어, 정상세포가 암세포로 분화되면서 저산소 환경과 영양분 부족 환경에 처하게 되면 스트레스가 심해지면서 세포는 회생 가능성이 낮다고 판단하여 세포자살(apoptosis) 경로를 촉진한다. 이 때 오토파지는 노폐물의 재생을 통해 지속적인 에너지를 공급하고 여러 세포생존 경로를 유지시켜 암 발달 과정에 안정성을 부여하게 된다. 이러한 오토파지의 특성상 암 발달과정에서 오토파지가 종양촉진인자인지 종양억제인자인지 명확히 결론짓기 어려우나 최근 연구결과에 의하면, 종양형성 초기에는 종양억제인자로서 작용하고 종양이 상당부분 진행된 경우에는 종양촉진인자로 작용한다는 견해가 지배적이다
오토파지와 항암제 내성
종양촉진인자로서 오토파지는 기존 항암제의 내성과 관련이 있어 항암제 개발 연구자들의 주목을 받고 있다. 일례로, 전이성 또는 진행성 비소세포폐암의 치료제로 사용되고 있는 EGFR TKI (tyrosine kinase inhibitor)의 경우 초기에는 치료에 효과적이나 장기간 투여 시 암세포에서 오토파지 작용으로 인한 내성이 보고되고 있다. 이 때 활성화되는 오토파지를 일명 ‘세포보호성 오토파지(protective autophagy)’라 명명하고 활발한 연구가 진행되고 있으며, 폐암 뿐만 아니라 췌장암, 대장암, 유방암, 방광암 등 다양한 암종에서도 보고되고 있다. 따라서, 오토파지의 억제를 통한 암치료법의 성패에 있어 정상세포에서는 작동하지 않고 암세포에서만 작동하고 있는 이 세포보호성 오토파지만을 정확히 타깃하는 기술이 중요한 이슈로 대두되고 있다.

▲오토파지와 항암제 내성(Source: J Adenocarcinoma. 2016, 1(2): 9)
또한, 오토파지가 면역반응(immune response)에 관련되어 있어 오토파지 억제를 통해 CD8+ T세포, Natural killer(NK)세포와 같은 암세포 살상세포를 활성화시켜 항암 효능을 유도하여 면역항암제에 저항성을 갖는 환자군에 대해 오토파지 저해제와 면역항암제와의 병용요법이 가능하다.
오토파지 저해제 연구개발 동향
항암 관련 오토파지의 중요성이 대두되면서, 오토파지와 관련하여 사용가능한 허가 제품인 말라리아 치료제 히드록시클로로퀸(HCQ)과 클로로퀸(CQ)이 주목받게 되었다. 현재 전 세계적으로 개발 중인 암 치료용 오토파지 저해제는 기존의 말라리아 치료제인 HCQ, CQ를 이용한 병용투여 임상개발이 대부분이며, 개발단계는 대부분 임상 1/2상 단계이다. 불응성 피부, 뇌, 혈액 및 기타 암 환자를 대상으로 HCQ 또는 CQ와 방사선 요법, 화학요법 및 표적 항암제를 병용한 약 70여건의 임상연구가 진행되고 있다(Clinicatrials.gov 2020년 11월 기준). 현재 여러 임상연구가 진행되고 있으나 기존 말라리아 치료제의 투여량보다 더 많은 양을 투여해야 항암 효과가 나타나고 암세포에 비특이적으로 작용하기 때문에 망막독성 등의 부작용으로 고용량 투여가 어려운 상황이다.
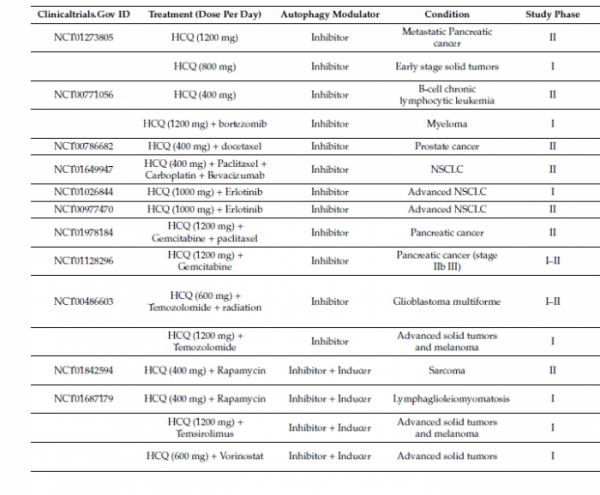
▲HCQ, CQ 항암 연구개발 동향(Source: Cancers, 2019, 11(10): 1599)
많은 제약.바이오사들이 HCQ, CQ와 같은 리소좀(lysosome)을 타깃으로 하는 약물후보군이나 자가포식소체(autophagosome)형성에 관여하는 ULK 저해제, VPS34 저해제 등 오토파지 기전에 관련된 효소들을 억제하는 방식으로 약물을 개발하고 있다. 이 경우, 암세포 뿐만 아니라 정상세포에서도 오토파지가 꺼져버리고, 오토파지와 관련된 효소들이 100% 오토파지에만 관련된 것이 아니라 여기저기 다른 곳에서도 작용되기 때문에 이러한 접근 방식으로는 부작용을 피할 수 없게되어 안전성이 보장되지 않는다. 즉, Off target effect에 의한 부작용이 나타날 수밖에 없다는 것이다.
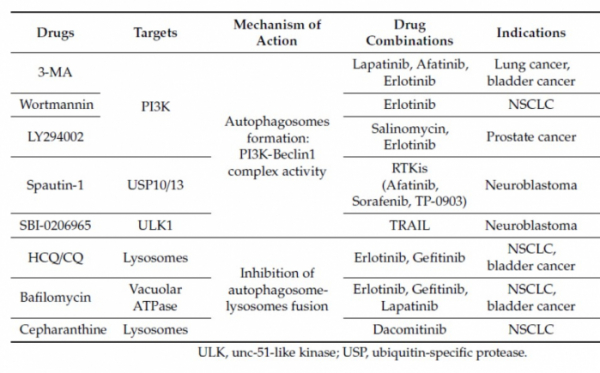
▲오토파지 저해제(Source: Cancers, 2019,11(9):1374)
미국에서 바이오 벤처들이 선택성이 높은 화학약물을 이용한 연구를 진행하고 있지만, 이 또한 태생적 한계가 있다. 최근 Vescor Therapeutics, Deciphera Pharmaceuticals 및 Sprint Bioscience 등의 바이오 벤처들이 자가포식 경로의 선택성이 높은 저해제를 찾는 연구들을 활발하게 진행하고 있다. PPT1 단백질이 정상세포보다 암세포에서 높게 발현되어 있음을 확인하여 PPT1을 타깃으로 하는 약물이 개발 중이지만, 해당 약물은 CQ의 이량체로서 CQ가 작용하는 기전인 lysosome inhibitor의 기능까지 가지고 있어 off target으로 인한 독성 문제를 해결해야만 한다. VPS34 같은 경우는 오토파지에서 하는 역할보다 다른 곳에는 하는 역할이 더 크기 때문에 억제하였을 때 오토파지가 꺼지는 것이 문제가 아니라 다른 기능까지 꺼지는 문제가 생길 수밖에 없다.
결국 오토파지에 관여하는 세포내 물질은 암세포든 정상세포든 동일하기 때문에 암세포에서만 오토파지를 켜고 끄는 스위치를 찾아내는 것이 암세포에서만 선택적으로 오토파지를 끌 수 있는 주요 포인트가 된다. 이 핵심 스위치를 찾아내고 그 스위치가 조절되는 기전을 밝히게 되면 암에 선택적인 오토파지 저해제를 개발할 수 있게 된다.
항암 치료에서 오토파지의 중요성은 이미 많이 알려져 있어 글로벌 수준의 다수 바이오제약 기업들이 항암관련 오토파지 연구를 진행하고 있지만, 암 비선택적인 오토파지 조절이라는 한계상황에 머물러 있는 실정이다. 그러나 국내 바이오 기업 중 이에 대한 솔루션을 가지고 암 선택적인 오토파지 저해제를 개발하고 있는 회사가 있어 소개하고자 한다.
“엘베이스, 오토파지 타깃 신약물질 개발.."현재 임상 준비중”
엘베이스는 암세포의 성장과 전이, 면역회피 등에 중요한 역할을 하는 특정 단백질을 직접 억제하는 신약물질을 개발하는 회사로 현재 비임상시험이 진행중이며 내년 임상시험을 준비중에 있다. 현재 엘베이스에서 보유한 신약 파이프라인들은 PPI(protein protein interaction) 저해제를 통한 오토파지 억제 기전에 바탕을 두고 있다. 가장 개발단계가 앞서 있는 비소세포폐암 치료 약물후보의 경우는 오토파지를 타깃으로 개발하는 모든 회사들의 숙제인 cytotoxic 오토파지와 cytoprotective 오토파지의 구별문제를 해결한 혁신적인 신약후보물질이다.
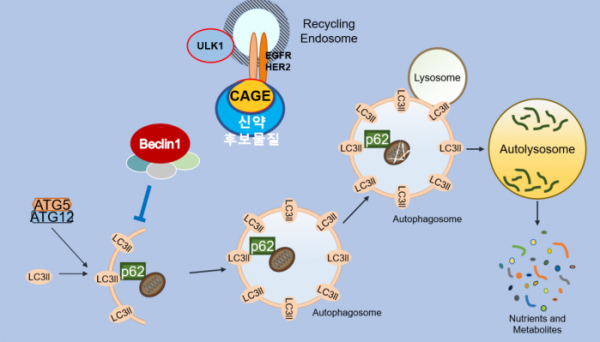
▲엘베이스 신약후보물질의 약물 기전
오토파지 억제에 쓸 수 있는 기존 허가약물인 HCQ나 CQ의 경우는 오토파지 기작의 마지막 단계인 라이소좀과 오토파고좀의 결합을 저해함으로써 cytotoxic 오토파지와 cytoprotective 오토파지의 구별이 현실적으로 불가능하였고 이에 따른 부작용문제를 피할 수 없었다. 이러한 문제의 해결을 위한 최근의 연구동향은 오토파지 기작 상단에 관여하는 단백질을 타깃으로 하는 약물개발이다. 하지만 이 경우도 이러한 타깃 단백질들이 오토파지 외에도 관여하고 있기에 선택성의 문제가 대두되어 또 다시 부작용이라는 큰 벽을 넘지 못하고 있는 상황이다.
그러나 엘베이스가 20여년간의 연구결과를 토대로 개발중인 신약후보물질은 오토파지의 상단단계에 관여하는 단백질 타깃과 암이 진행된 상태에서만 선택적으로 결합하여 오토파지를 과활성화시켜 암세포로 하여금 cytoprotective 오토파지를 활용하게 하는 신규단백질 타깃 간의 단백질 상호작용을 억제함으로써 정상세포의 오토파지 활성은 저해하지 않은 특징을 갖고 있다. 따라서 기존 경쟁약물들의 경우는 효능시험 단계에서조차 부작용문제에 부딪혀 개발이 중단되는 사례가 많으나 엘베이스의 후보약물은 이러한 부작용은 관찰되지 않아 원활히 비임상 시험을 진행하고 있다.
더욱이 최근의 연구결과에 의하면 엘베이스의 신약후보물질은 암세포의 cytoprotective 오토파지 활성을 정상세포의 수준으로 낮출 뿐 아니라 종양미세환경의 구성요소 중 하나인 면역세포(mast cell)과 암세포 간에 엑소좀을 통하여 전달되는 특정 단백질 역시 억제할 수 있음이 밝혀져 암세포 내성억제와 종양미세 환경조절을 통한 추가적 상승효과가 기대되고 있어 약물개발에 대한 기대가 높아지고 있다.
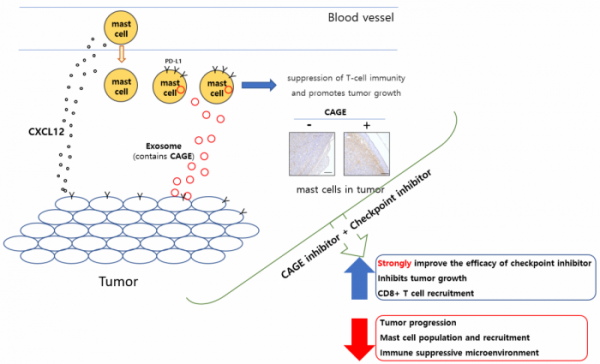
▲면역항암제과의 병용 치료
다시 말하면, 최근에 많은 바이오 기업들이 여전히 효능이 더 좋은 표적항암제와 면역항암제를 개발하기 위하여 약물 개발에 힘쓰고 있지만, 과연 현재 우리에게 암과 싸울 수 있는 무기가 없는가를 생각해보면 그렇지만은 않다. 현재, 다양한 치료제가 사용되고 있으나, 독성 및 내성문제로 인해 기존 치료제들을 지속적으로 사용하는 것은 한계가 있다. 엘베이스는 진정한 first-in class로서 새로운 기전에 입각하여 내성을 극복하겠다는 비전을 가지고 항암신약을 개발하는 중이다. 엘베이스는 더 나아가 해당 단백질의 오토파지 기전을 기반으로 한 신약물질 screening platform을 개발하였고, 이 screening platform을 이용하여 다양한 암종에 적용 가능한, 오토파지를 억제하는 물질을 개발하고 있다.
참고 문헌
1. Targeting Autophagy in Cancer, Nat Rev Cancer. 2017 17(9):528-542
2. The Four Faces of Autophagy- Implications for Cancer Therapy, Cancer Res. 2014 74(3):647-51
3. EGFR-Signaling and Autophagy: How they Fit in the Cancer Landscape, J Adenocarcinoma. 2016; 1(2): 9.
4. Targeting Autophagy for Cancer Treatment and Tumor Chemosensitization, Cancers, 2019, 11(10): 1599
5. Targeting Autophagy for Overcoming Resistance to Anti-EGFR Treatments, Cancers, 2019,11(9):1374
6. Anticancer autophagy inhibitors attract ‘resurgent’ interest, Nature, 2019, 18(6): 408-410






![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/74/74/2071974.jpg)






![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2071974.jpg)



