국제
AO, 발목뼈 '3D프린팅’ 이식재 FDA 허가
바이오스펙테이터 서일 기자
발목관절 무혈성 괴사 적응증..인도주의적 의료기기 면제제도 혜택

의료용 3D 프린터 회사 애디티브 오써피딕스(Additive Orthopaedics, AO)의 ‘환자 맞춤형 목말뼈 스페이서(Patient Specific Talus Spacer, PSTS)’가 발목관절 무혈성 괴사(avascular necrosis)의 치료 목적으로 미국 식품의약국(FDA)의 허가를 받았다. FDA는 PSTS가 목말뼈를 대체할 첫 이식재(implant)라고 설명했다.
AO는 지난 17일(현지시간) FDA가 PSTS의 판매를 허가했다고 발표했다. PSTS는 3D 프린터의 적층(additive manufacturing) 방식으로 제작되는 코발트와 크롬의 합금 이식재로, CT스캔 이미지를 기반으로 개별 환자의 목말뼈에 맞게 제작된다.
발목관절 무혈성 괴사는 뼈가 부러지거나 탈골이 일어나는 경우 혈류가 차단되면서 뼈 조직이 죽는 질환이다. 괴사와 그로 인한 통증이 심한 경우에는 다리를 절단하기도 한다. 그레그 코발치크(Greg Kowalczyk) AO 대표는 “현재 표준치료인 슬하부 절단(below-the-knee amputation) 또는 관절 유합(joint fusion) 수술을 하게 되면 발목을 움직일 수 없다”며 “PSTS의 이식은 이를 해결할 수 있을 것”이라고 말했다.
AO는 PSTS를 곧바로 판매 개시할 계획이다.
이번 허가는 PSTS가 인도주의적 사용 의료기기(humanitarian use device, HUD)로 지정되면서 인도주의적 의료기기 면제제도(humanitarian device exemption, HDE)를 통해 허가 기준을 면제받은 결과다. 인도주의적 사용 의료기기 지위는 미국내 연 8000명 이하의 환자에 영향을 미치는 질환의 치료와 진단을 목적으로 개발된 기기에 부여된다.
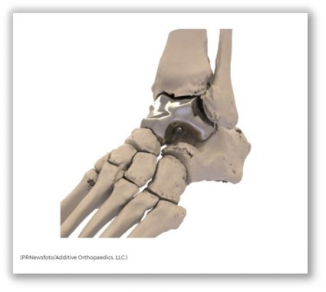
▲출처: Additive Orthopaedics의 보도자료














![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)



