국제
릴리, '코로나19 항체' 병용 2nd 3상 "입원·사망 87%↓"
바이오스펙테이터 윤소영 기자
‘밤라니비맙(bamlanivimab, LY-CoV555)+에테세비맙(etesevimab, LY-CoV016)’ 병용 투약군서는 사망환자 발생하지 않아..코로나19 변이에도 일정한 치료 효과

일라이릴리(Eli Lilly)의 ‘밤라니비맙(bamlanivimab, LY-CoV555)+에테세비맙(etesevimab, LY-CoV016)’ 병용요법이 두번째 임상 3상에서 입원 및 사망위험을 위약군 대비 87% 낮춘 결과로 코로나19 치료 효능을 증명했다. 이 병용요법은 지난달 미국 식품의약국(FDA)으로부터 코로나19 치료제로 긴급사용승인(EUA)을 받았다.
릴리는 9일(현지시간) 밤라니비맙과 에테세비맙을 병용으로 사용한 코로나19 임상 3상 결과를 발표했다.
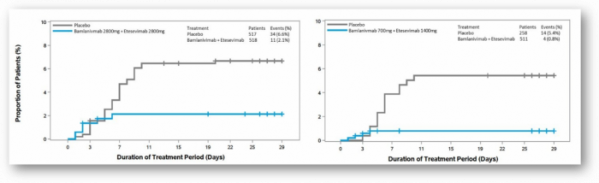
임상은 코로나19 증상이 경증~중등도인 고위험군 환자 769명을 대상으로 진행됐다. 임상의 항체치료군 511명은 밤라니비맙(bamlanivimab, LY-CoV555) 700mg과 에테세비맙(etesevimab, LY-CoV016) 1400mg을, 위약군 258명은 위약을 정맥으로 투약받았다.
임상 결과 항체 투약군에서는 4건의 입원 혹은 사망 사건이 발생했고, 위약군에서는 15건이 발생했다(NCT04427501). 이에 릴리는 두 항체의 병용요법이 위약 대비 입원 및 사망 위험을 87% 감소시켰다고 발표했다. 또한 이번 임상에서 총 4명의 사망 환자가 발생했는데, 이는 모두 위약군 환자였다고 강조했다.
릴리는 지금까지 수행한 다양한 임상을 통해 일정한 효능 및 안전성 결과를 확인했다고 발표했다. 릴리는 지난 임상에서 두 항체 병용시 사망 및 입원 위험을 70% 줄인 결과를 발표했었다. 또한 밤라니비맙 단독으로 치료한 경우 입원 및 응급실 방문 비율이 약 70% 감소했다는 결과도 발표했었다. 특히 밤라니비맙과 에테세비맙을 병용투여한 군에서는 사망환자가 발생하지 않는다는 점도 일관적이다.
이번 발표는 올해 1월 발표한 코로나19 항체 병용 임상 3상 결과에 이은 두번째 항체 병용 3상 결과다. 1월에 발표한 임상은 밤라니비맙과 에테세비맙을 각각 2800mg씩 투여한 임상이었고, 이번 임상은 밤라니비맙과 에테세비맙을 각각 700mg, 1400mg 투여한 임상이었다는 차이가 있다.
릴리는 두 항체의 용량 조합 효능을 보는 임상 2상도 동시에 진행하고 있었는데 그 임상에서 밤라니비맙과 에테세비맙을 각각 2800mg씩 투여한 경우와 각각 700mg, 1400mg씩 투여한 경우 비슷한 효능을 보인다는 것을 확인했다. 이에 릴리는 공급에 더 유리한 700mg, 1400mg 조합으로 지난 2월 FDA의 긴급사용승인을 받았다.
다니엘 스코브론스키(Daniel Skovronsky) 릴리 CSO는 “이번 임상 결과는 이미 긴급사용승인 받은 밤라니비맙 700mg과 에테세비맙 1400mg 병용 요법에 대한 근거 자료가 되고 의료 관련 종사자들에게 릴리의 항체치료제에 대한 정보를 제공한다”며 “새로운 종류의 변이 바이러스의 출현에도 모든 코호트에서 이전의 임상과 일정한 결과가 나타난다는 점은 밤라니비맙+에테세비맙 병용요법이 다양한 변이 바이러스에도 효과가 있다는 것을 의미한다”고 말했다.
한편, 릴리는 지난해 11월 삼성바이오로직스와 밤라니비맙을 포함한 코로나19 항체에 대한 장기 생산 계약을 맺었다.
▲임상 결과(일라이릴리 홈페이지)
















