국제
TG, 'CD20 항체' 다발성경화증 비교3상 “연간재발률↓”
바이오스펙테이터 서윤석 기자
1차치료제 사노피 ‘오바지오(Aubagio)’와 직접비교(head-to-head) 3상..연간재발률(ARR) 최대 60%, MRI 뇌병변 90% 이상, 질병개선도(CDI), NEDA 도달률 최대 2배 이상 개선

TG테라퓨틱스(TG Therapeutics)가 개발중인 CD20 항체 ‘유블리툭시맙(ublituximab)’이 재발성 다발성경화증(multiple sclerosis) 환자를 대상으로 한 직접비교 임상 3상에서 1차 치료제인 사노피(Sanofi)의 ‘오바지오(Aubagio, teriflunomide)’보다 연간 질병재발률(ARR)을 49~60% 감소시킨 결과를 내놨다. 또 질병재발률을 포함한 다발성경화증에 대한 치료평가 지표인 NEDA(no evidence of disease activity) 달성률도 2배 이상 높았다.
유블리툭시맙은 B세포의 수를 감소시켜 과다한 면역반응을 억제하는 방식으로 자가면역반응을 저해하는 기전이다. 오바지오는 다발성경화증 1차치료제로 사용되는 약물로 피리미딘의 합성을 막아 면역세포의 양을 저하시켜 면역반응을 억제하는 방식이다.
만약 유블리툭시맙이 승인받게 된다면 B세포를 타깃하는 약물인 로슈(Roche)의 ‘오크레부스(Ocrevus, ocrelizumab)’와 노바티스(Novartis)의 ‘케심타(Kesimpta, ofatumumab)’와 경쟁하게 될 것으로 보인다. 오크레부스는 2017년, 케심타는 2020년 미국 식품의약국(FDA)로부터 승인받은 약물이다.
특히 유블리툭시맙은 첫 투약 후 6개월에 한번 1시간동안 투여하는 방식으로, 2시간동안 투여해야 하는 오크레부스보다 경쟁력을 가질 것으로 보인다. 오크레부스는 지난해 약 47억달러의 매출을 올렸다.
TG테라퓨틱스는 16일(현지시간) 재발성 다발성경화증을 대상으로 진행한 CD20항체 유블리툭시맙의 임상 3상(NCT03277261, NCT03277248) 두 건에서 연간 재발률(annualized relapse rate, ARR)을 유의미하게 개선하며 1차 종결점을 충족시킨 결과를 발표했다. 또 MRI 분석을 통한 뇌병변도 개선하며 2차 종결점도 충족시켰다.
TG는 오는 3분기까지 유블리툭시맙의 신약허가신청서(BLA)를 제출할 계획이다.
발표에 따르면 TG는 UltimateI과 II 등 2건의 임상을 진행했으며, 각각 673명, 660명 총 1333명의 재발성 다발성경화증 환자를 1:1로 나눠 유블리툭시맙과 오바지오를 투여해 96주간 임상을 진행했다. 유블리툭시맙은 치료 첫날 4시간 동안 150mg 정맥주사 후, 매 6개월마다 1시간 동안 450mg을 투여했고, 오바지오는 매일 1회 경구투여했다.
그 결과 Ultimate I에서 유블리툭시맙 투여군은 연간재발률(ARR)이 0.076로 오바지오 투여군 0.188보다 60%(p<0.0001) 감소했다. Ultimate II에서 유블리툭시맙 투여군의 연간재발률(ARR)은 0.091로 나타나 오바지오 투여군 0.178보다 49%(p=0.0022) 낮았다.
또 MRI를 통해 분석한 T1+Gd 병변수는 유블리툭시맙 투여군에서 각각 0.016과 0.009으로 나타나 오바지오 투여군 0.491과 0.250과 비교해 각각 97%, 96% 감소했다(p<0.0001). 새로운 또는 확대된 T2병변수(new or enlarging T2 lesions)도 유블리툭시맙 투여군에서 각각 92%, 90% 감소했다(p<0.0001).
장애진행률(confirmed disability progression, CDP)은 유블리툭시맙 투여군과 오바지오 투여군에서 유의미한 차이를 보이지 않았다. 그러나 장애개선도(confirmed disability improvement, CDI)는 유블리툭시맙 투여군에서 12주차에 12%(vs 6%, p=0.0003), 24주차에 9.6%(vs 5.1%, p=0.0026)로 오바지오 투여군보다 유의미하게 개선된 결과를 나타냈다.
마지막으로 NEDA(no evidence of disesase acitivity)에 도달한 환자비율은 유블리툭시맙 투여군에서 가각 44.6%(vs 15%, p<0.0001), 43%(vs 11.4%, p<0.0001)로 오바지오 투여군과 비교해 198%, 277% 더 높았다. NEDA는 다발성경화증이 치료됐는지 평가하는 지표로 재발률, 장애진행률, 장애개선도, MRI 뇌병변평가 등을 분석한다.
유블리툭시맙은 임상기간 동안 심각한 안전성 문제가 보고되지 않았으며, 부작용이 발생한 비율은 오바지오 투여군과 유사했다. 유블리툭시맙 투여군에서 가장 흔하게 나타난 이상반응은 주입관련 반응으로 약 47.7%(vs 12.2%) 환자들이 경험해 오바지오 투여군보다 높았다.
로렌스 스타인만(Lawrence Steinman) 스탠포드대 신경과 교수이자 임상글로벌 연구위원장은 “유블리툭시맙이 다발성경화증의 재발을 효과적으로 감소시켰을 뿐 아니라 뇌병변을 모두 개선했다”며 “낮은 연간재발률, 뇌병변의 감소 등으로 인해 유블리툭시맙으로 치료받은 환자의 약 절반에게서 질병 활성의 증거를 확인하지 못했다”고 말했다.
마이클 웨이스(Michael S. Weiss) TG 테라퓨틱스 CEO는 “이번 유블리툭시맙의 데이터가 안전성 프로파일을 가진 효과적인 치료옵션임을 보여준다”며 “만약 승인되게 될 경우 유블리툭시맙은 첫 투여후 6개월마다 1시간에 걸쳐 투여하는 유일한 CD20 항체가 된다”고 말했다.
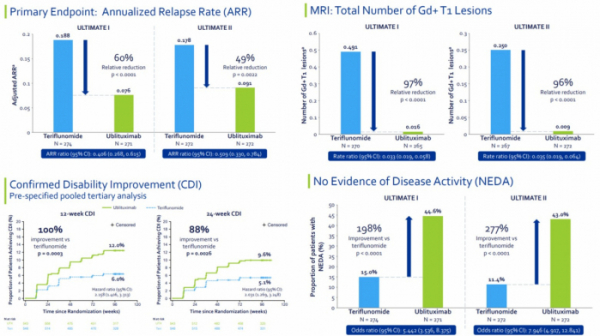
(TG발표자료 참조)





![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/74/74/2071974.jpg)







![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2071974.jpg)


