국제
버텍스, 또 AATD 임상중단.."효능 확인, But 이점부족"
바이오스펙테이터 윤소영 기자
임상 2상서 VX-864 효능 및 안전성 확인..2022년까지 다른 후보물질로 AATD 임상 진입 목표

버텍스(Vertex)가 알파-1 항트립신결핍(AATD) 치료제로 개발중이던 'VX-864'에 대한 임상을 더 이상 진행하지 않기로 했다. 임상 2상 결과를 통해 효능과 안전성은 확인했지만, 치료제로 사용할 정도의 이점에는 부족하다는 이유에서다.
버텍스는 지난해 10월에도 AATD 임상을 중단한 바 있다. 당시 AATD 치료제 후보물질인 ‘VX-814’로 임상 2상을 진행했는데, 일부 환자에게서 8배 높은 간수치(AST/ALT)가 나타나 임상을 중단했다. 당시 버텍스는 VX-814와 구조적으로 다른 약물인 VX-864로 AATD 임상을 진행할 것이라고 발표했다. 두 약물은 모두 AAT 단백질이 정상적으로 접히도록 하는 저분자화합물의 교정제(corrector)다.
버텍스는 지난 10일(현지시간) VX-864로 진행한 알파-1 항트립신결핍(alpha-1 antitrypsin deficiency, AATD) 임상 2상 결과를 발표하며 앞으로 VX-864로 임상을 진행하지 않겠다고 밝혔다. 이 소식에 버텍스 주가는 전날 종가 대비 10% 이상 떨어졌다.
AATD는 SERPINA1 유전자의 변이로 AAT(alpha-1 antitrypsin) 단백질이 잘못 접혀(misfolding) 간에서 배출되지 못해 혈중 AAT 농도가 낮아지며 발생하는 질환이다. 혈중 AAT 농도가 낮아지면 엘라스테이즈(elastase)가 조절되지 않아 엘라스틴(elastin) 단백질이 과도하게 분해되는데, 이는 폐의 탄성력(elasticity)을 떨어뜨려 폐에 손상을 입히게 된다. VX-864는 경구용의 저분자 화합물로 AAT 단백질의 비정상적인 접힘을 바로잡는 역할을 한다는 설명이다.
버텍스는 40명의 환자를 대상으로 VX-864의 효능을 보기 위한 임상 2상을 진행했다(NCT04474197). 환자들은 위약 혹은 VX-864(100mg, 300mg, 500mg)를 복용했으며 임상의 1차 종결점은 복용 28일째 기능을 하는 AAT 단백질(functional AAT, fAAT)의 혈중 레벨 변화였다.
발표에 따르면 임상 결과 VX-864를 복용한 환자군의 혈중 fAAT 농도는 위약군 대비 평균 2.2~2.3 마이크로몰랄(micromolar) 상승했다. 또한 VX-864 복용 7일이 지나자 모든 용량군에서 fAAT 레벨이 상승했으며 이는 28일까지 지속됐다. 2차 종결점인 혈중 AAT 항원(antigenic AAT) 레벨 역시 위약군 대비 VX-864군에서 평균 2.7~3.5 마이크로몰랄 상승했다.
이번 결과로 버텍스는 VX-864의 효과와 기전에 대해 다시 한번 증명할 수 있었지만, 이는 임상적 이점을 찾을 수 있는 유효한 결과는 아니라는 결론을 내렸다. 따라서 버텍스는 VX-864로 앞으로의 임상은 진행하지 않기로 했다.
VX-864의 안전성 결과는 양호했다. 내약성이 확인됐으며 부작용으로 치료를 중단한 환자는 없었다. 치료관련 심각한 부작용이 나타난 환자도 없었다. 가장 흔한 부작용으로는 설사와 메스꺼움이 나타났고, 간기능 테스트(Liver function test, LFT) 역시 VX-864군과 위약군의 결과가 비슷했다.
버텍스는 효능을 높인 새로운 AAT 교정제(corrector) 저분자화합물로 2022년 AATD 임상 진입을 목표로 하고 있다고 밝혔다.
카르멘 보직(Carmen Bozic) 버텍스 CMO는 “AAT 단백질 교정제 저분자화합물로 fAAT와 AAT 항원 레벨의 상승을 모두 확인한 결과는 이번이 처음이다. 위약군과 비교했을 때 fAAT가 확실히 상승했고 안전성 결과도 좋다”며 “이번 임상 결과를 바탕으로 다음 AAT 교정제 저분자화합물로 AATD 치료제 개발을 진행할 것”이라고 말했다.
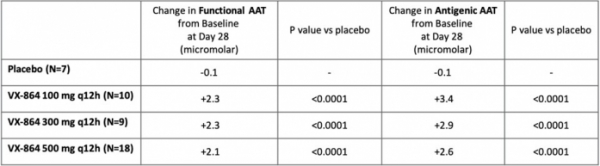
▲VX-864 임상 2상 결과(버텍스 홈페이지)

















