기업
한올바이오 'FcRn', 중증근무력증 中 2상도 "효능확인"
바이오스펙테이터 김성민 기자
1차 및 2차 충족점에서 개선효과 확인, 부작용 이슈 없어..."하반기 중증근무력증 대상 중국 임상3상 계획"
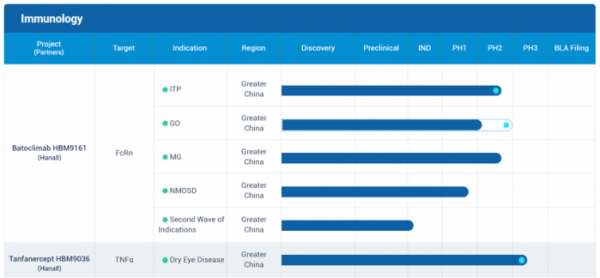
▲하버바이오메드 면역질환 파이프라인 중 한올바이오파마서 라이선스인한 FcRn 항체(HBM9161), TNF-alpha 약물(HBM9036) 진행현황
한올바이오파마(HanAll Biopharma)의 FcRn 항체 ‘바토클리맙(batoclimab, HL161; HBM9161)’에 대한 중국 파트너사인 하버바이오메드(Harbour BioMed)가 전신성 중증근무력증(generalized myasthenia gravis, gMG) 대상 임상2상에서 1차 충족점에 도달한 결과를 지난 6일 발표했다.
바토클리맙은 올해 2월 글로벌 파트너사 이뮤노반트(Immunovant)가 콜레스테롤과 저밀도지단백(LDL)이 증가하는 부작용으로 임상 중지를 결정했다가, 4달만인 6월에 환자를 모니터링한 결과 안전성을 관리할 수 있다는 판단하에 임상 재개를 결정한 약물이다. 이뮤노반트는 이르는 올해말 중증근무력증 대상 임상3상 등 여러 임상개발 프로그램을 다시 시작할 계획이다.
또한 중증근무력증 대상 미국 임상2상에 이어, 중국 임상2상에서도 바토클리맙의 효능을 확인했다는 점에서도 의미를 가진다. 하버바이오메드는 긍정적인 효능 데이터를 발표했으며, 부작용 이슈도 없었다. 이로써 한 고비를 넘긴 모습이다. 이번 결과에 따라 하버바이오메드는 오는 하반기 중증근무력증 대상 임상3상에 들어갈 계획이다.
임상2상은 중등도 내지 심각한 전신성 중증근무력증 환자 30명을 대상으로 바토클리맙 340mg(10명), 680mg(11명) 또는 위약(9명)을 주마다 6주 동안 피하투여하는 임상으로 진행됐다.... <계속>
















