국제
머크, '키트루다' 자궁경부암 1차 FDA 승인
바이오스펙테이터 차대근 기자
'키트루다+화학요법', PD-L1 발현 지속성/재발성/전이성 자궁경부암 1차 치료제 승인..전체생존기간(OS), 무진행생존기간(PFS) 개선, 사망위험 36% 감소

미국 머크(MSD)는 지난 13일(현지시간) 미국 식품의약국(FDA)이 PD-1 항체 ‘키트루다(Keytruda, pembrolizumab)’와 화학요법 병용을 PD-L1을 발현하는 지속성/재발성/전이성 자궁경부암(persistent, recurrent or metastatic cervical cancer) 1차 치료제로 승인했다고 밝혔다.
PD-L1 발현 기준은 복합양성점수(Combined Positive Score, CPS)가 1이상인 것으로 정의됐다. 복합양성점수는 PD-L1 염색이 되는 세포수를 전체 종양세포수로 나누고 100을 곱한 것이다. 이번 승인은 '아바스틴(Avastin, Bevacizumab)' 병용이 가능하다는 내용을 포함했다.
이번 승인은 지속성/재발성/전이성 자궁경부암 환자를 대상으로 키트루다+화학요법 병용의 효능과 안전성을 평가한 임상3상 결과에 기반한다(NCT03635567). 총 548명의 참여 환자 중 키트루다+화학요법군에는 273명, 위약+화학요법군에 275명이 배정됐다. 환자들은 3주마다 200mg의 키트루다 또는 위약을 투여 받았으며, 화학요법으로는 ‘파클리탁셀(paclitaxel)+시스플라틴(cisplatin)’ 또는 ‘파클리탁셀+카보플라틴(carboplatin)’을 3주마다 투여받았다. 전체 환자들의 63%는 임상 진행과 함께 아바스틴도 투여받았다. 1차 종결점은 전체생존기간(OS)과 무진행생존기간(PFS)이었다.
임상결과, 키트루다+화학요법군은 위약+화학요법군 대비 OS에서 사망위험을 36% 감소시켰으며(HR=0.64, p=0.0001), PFS에서도 유의미하게 개선된 결과를 보였다(HR=0.62, p<0.0001). 객관적반응률(ORR)은 키트루다+화학요법군과 위약+화학요법군에서 각각 68%와 50%, 반응지속기간(DOR)은 각각 18개월과 10.4개월이었다. 결과는 아바스틴 병용여부와 상관없이 일정했다.
키트루다+화학요법군의 4.6%는 치명적인 이상반응(Fatal adverse reactions)을 경험했다. 치명적인 이상반응은 출혈 3건, 패혈증 2건, 급성 심근경색 1건, 심정지 1건 등이었다. 심각한 이상반응(Serious adverse reactions)은 키트루다+화학요법군의 50%에서 발생했으며, 호중구감소증(6.8%), 요로감염(5.2%), 빈혈(4.6%) 등이었다. 이상반응으로 키트루다 투여를 중단한 환자 비율은 15%였으며, 1%의 환자들은 대장염으로 인해 영구적으로 키트루다 치료를 받지 않게 됐다.
로이 베인즈(Roy Baynes) 머크 연구소(Merck Research Laboratories) CMO 겸 글로벌임상 개발 대표이자 수석부사장(senior vice president)은 “특정 종류의 자궁경부암 환자들에게 새로운 치료옵션을 제공한다는 점에서 이번 승인은 의미가 있다”며 ”36%의 사망위험 감소를 보여준 데이터는 설득력이 있으며, 이번 승인으로 PD-L1 발현 지속성/재발성/전이성 자구경부암에 대한 새로운 1차 치료옵션이 제공된다”고 말했다.
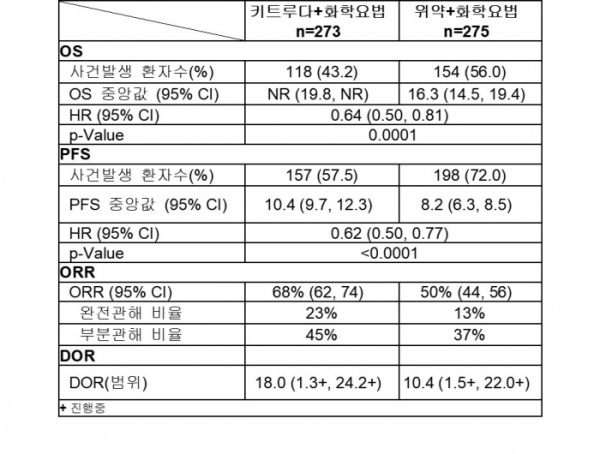
▲임상3상 결과(바이오스펙테이터 재구성)



















