탐방
앱티스, '차세대 ADC 플랫폼' 3가지 차별점은?
바이오스펙테이터 서윤석 기자
항체 엔지니어링없이 특정 부위, 일정 수 페이로드 결합..ADC 효과∙안전성∙CMC 장점..자체 개발 HER2 ADC 'AP001', 위암 및 유방암 마우스서 대조약물 대비 효과적 항암효과

앱티스(AbTis)가 항체 엔지니어링없이 특정 부위에, 일정한 수의 페이로드를 결합할 수 있는 차세대 항체약물접합체(ADC) 개발에 나섰다. 자체 구축한 링커(linker) 기술을 바탕으로 기존 ADC 보다 효과와 안전성을 높일 수 있을 것으로 회사측은 기대하고 있다.
ADC는 암세포에 과다하게 발현되는 단백질 항원을 특이적으로 인식하고 항체와 결합된 페이로드(payload, 독성약물)를 암세포 내부로 전달해 항암효과를 높인 일종의 표적항암제다. ADC는 특정 종양을 타깃하는 항체, 약물을 결합해주는 링커, 치료효과를 내는 페이로드로 구성된다. 특히 링커(linker)는 ADC의 효과, 안전성, 생산성에 영향을 미치는 핵심요소다.
정상전 앱티스 대표는 “자체 개발한 ADC 링커 플랫폼 ‘앱클릭(AbClick)’을 기반으로 효과와 안전성을 높인 ADC 약물을 개발하고 있다”며 “앱클릭 플랫폼은 항체에 돌연변이 없이 특정부위에 페이로드를 결합시킬 수 있고, 체내 암세포에서 쉽게 유리되며, 약물-항체비율(drug-antibody ratio, DAR) 조절이 가능해 CMC(chemistry, manufacturing, and control)가 용이한 점 등의 차별점을 가지고 있다”고 말했다.
ADC는 암세포에 특이적으로 결합하는 항체를 이용해 치료효과를 내는 페이로드를 전달함으로써 항암효과는 높이고 부작용은 낮춘 특징을 가진다. ADC는 특정 위치에 페이로드를 붙이기 위해서는 항체를 엔지니어링해 돌연변이를 만들어야 했으며 DAR 조절이 어려운 한계가 있었다. 이는 품질관리와 생산과정에서 단점으로 여겨지던 부분이다.
앱티스는 지난 2016년 정상전 성균관대 교수가 설립해 ADC 링커 플랫폼 기술의 고도화를 진행해 왔다. 앱티스는 지난해 레고켐바이오 출신의 오영수 CTO와 미국 머크(MSD), GSK 등에서 재직한 최원 CSO를 영입했다. 현재 석박사급 연구인력을 포함해 20여명의 임직원이 근무중으로 인력을 충원하고 있다. 앱티스는 지난해 2월 시리즈B로 150억원을 유치해 현재까지 시리즈A 포함 약 230억원의 투자금을 모았다. 바이오스펙테이터는 앱티스의 ADC 플랫폼 기술의 차별성과 연구중인 파이프라인에 대해 알아봤다.
ADC 플랫폼 ‘앱클릭(AbClick)’..“기존항체 이용, DAR 조절 가능, 위치 특이적 결합”
정 대표는 “자체적으로 자사의 기술을 3세대 ADC 링커로 구분하고 있다”며 “이전 세대 링커기술들과는 달리 돌연변이 항체제작이 필요없고, 일정한 수의 페이로드 탑재가 가능하며, 위치 특이적(site specific)으로 페이로드를 결합시킬 수 있는 등 차별점을 가지고 있다”고 말했다. 앱티스의 ADC 플랫폼 앱클릭을 기반으로 안전성, 유효성이 우수한 고품질 ADC 치료제를 개발할 수 있다는 설명이다.
현재 승인받은 ADC 약물은 항체를 구성하는 라이신(lysine)과 시스테인(cysteine) 아미노산의 곁사슬을 이용해 페이로드를 붙이는 방식이다. 항체 하나에는 약 90여개의 라이신(lysine)과 30여개의 시스테인(cytein)이 포함되어 있어 ADC의 효과와 안전성에 영향을 미치는 페이로드 위치와 DAR를 조절하기가 어려웠다.
씨젠(Seagen), 다이이찌산쿄(Daiichi Sankyo) 등은 환원제를 이용해 시스테인이 가진 이황화결합을 페이로드 도입이 가능한 치올(thol, SH)기로 바꿔 약물을 탑재했다. 랜덤하게 페이로드가 결합하기 때문에 일정한 DAR을 조절하는 것이 QC의 핵심으로 여겨졌다.
2세대 ADC는 항체 엔지니어링을 통해 특정위치에 돌연변이를 일으켜 시스테인을 도입하고 여기에 페이로드를 결합시킨다. 제넨텍(Genetech)의 ‘티오맙(THIOMAB)’이 대표적인 예다. 돌연변이 항체를 만드는 공정이 들어갔지만, 일정한 수의 페이로드를 특정한 위치에만 결합할 수 있는 장점을 가진다.
3세대 ADC는 앞선 세대의 장점을 모두 합쳤다. 항체의 특정부위에 결합하는 링커를 이용 페이로드를 도입하는 방식이다. 항체 돌연변이를 위한 엔지니어링 과정이 필요없고, 특정위치에 일정한 수의 페이로드를 결합할 수 있다. 앱티스의 ‘앱클릭’과 일본 아지노모토(Ajinomoto)의 ‘아지캡(AjiCAP)’이 대표적으로 항체의 라이신248(lysine 248) 부위에 약물을 결합시킨다.
앱티스의 앱클릭은 근접거리효과(proximity effect)를 이용해 항체 Fc 부위 라이신에 페이로드를 붙이는 기술로 앱클릭 스탠다드(Abclikc Standard)와 앱클릭 프로(Abclick Pro) 2가지 플랫폼을 구축했다. 약물의 반감기를 조절하는 세포수용체인 FcRN(neonatal Fc receptor) 결합유무가 두 플랫폼을 구별하는 포인트다. 앱클릭 스탠다드는 FcRN 결합부위가 없어 반감기가 짧고, 앱클릭 프로는 FcRNA과 결합해 상대적으로 반감기가 길다. FcRN이 항체 IgG와 결합하면 리소좀에 의해 IgG 분해가 억제되면서 재사용률이 높아지고, 반감기가 증가하게 된다.
정 대표는 “앱클릭 스탠다드는 링커의 반감기(half-life)가 짧은 특징을 가지고 있어 치료항체에 방사성물질(radio-immunothreapy)을 페이로드로 탑재해 방사성치료제로 개발하거나, 동반진단(companion diagnostics), 항암치료 예후분석 등으로도 응용할 수 있다”고 말했다. 앱티스는 암종에 ADC가 전달되는 시간을 고려해 앱클릭 스탠다드를 이용한 ADC는 혈액암을 대상으로 연구개발할 계획이다.
다음으로 앱클릭 프로는 반감기가 상대적으로 길어 고형암을 적응증으로 개발 중이다. 앱티스는 트라스투주맙(trastuzumab, 허셉틴)에 앱클릭 프로를 적용해 90% 이상의 수율(yield)로 4개의 페이로드가 결합(DAR4)하는 결과를 확인했다.
항체의 특정 위치에 페이로드를 결합하는 기술에 대한 관심은 지난달 이뤄진 딜에서도 볼 수 있다. 젠맙(Genmab)은 네덜란드 시나픽스(synaffix)와 4억1500만달러 규모의 파트너십을 맺고 항체엔지니어링 없이도 특정 위치에 페이로드를 탑재하는 기술을 확보했다. 시나픽스는 항체의 CH2 도메인에 있는 특정한 아스파라진(asparagine) 아미노산에 결합하는 글라이칸(glycan)을 이용해 페이로드를 탑재하는 기술을 보유하고 있다.
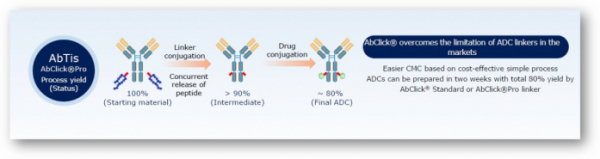
▲앱클릭 플랫폼 기술(앱티스 제공)
HER2 ADC ‘AP001’..”위암, 유방암 마우스 모델서 종양크기 감소”
앱티스가 앱클릭 프로를 적용해 연구중인 HER2 ADC ‘AP001’이 마우스모델에서 보인 항암효과를 살펴보자. AP001은 HER2 항체 '트라스투주맙'에 미세소관 저해제인 MMAE(monomethyl auristatin E)를 페이로드로 결합한 형태다.
먼저 앱티스는 HER2 양성 위암 세포주 NCI-NI87, 폐암 세포주 Calu-3, 유방암 세포주 JIMT-1, BT474를 이용해 AP001, 트라스투주맙, '캐싸일라(Kadcyla)'의 세포독성을 확인했다. 트라스투주맙은 HER2 항체, 캐싸일라는 HER2 ADC로 전이성유바암에 대해 승인받은 약물이다.
AP001의 IC50 값은 위암, 폐암, 유방암 세포주에서 각각 0.0012nM(vs 0.1nM), 0.0084nM(vs 1.4nM), 0.0079nM(vs 1.5nM), 0.0020nM(vs 0.041nM)로 캐싸일라와 비교해 높은 세포독성을 보였다. IC50은 세포생존율(cell viability)이 50%를 보일 때까지의 약물농도로 낮을수록 적은 용량으로도 효과적인 세포독성을 보인다는 의미다.
앱티스는 위암 및 유방암 마우스모델에서 AP001의 효과적인 항암효과를 확인했다. 구체적으로 앱티스는 AP001, 트라스투주맙, 캐싸일라를 위암 및 유방암 마우스모델에 동일용량으로 투여해 35일에 걸쳐 항암효과를 확인했다. 위암 마우스모델(NCI-NI87)에 약물투여 후 종양크기와 체중(body weight)을 분석한 결과, AP001 5mg/kg, 10mg/kg 투여군에서 종양크기가 완전관해에 가까운 수준으로 종양크기가 감소했다. 반면 AP001과 동일한 용량을 투여한 '캐싸일라'와 트라스투주맙 투여군은 대조군보다 종양크기가 감소하는 경향을 보였으나 AP001보다 항암효과는 낮았다.
AP001을 투여한 유방암 마우스모델(JIMT-1)에서도 종양크기가 완전관해 수준으로 감소했으며, 동일용량에서 트라스투주맙 및 캐싸일라는 항암효과가 거의 나타나지 않았다. 위암 및 유방암 마우스 모델에서 체중은 35일간 차이가 없어 실험실 수준에서 독성문제가 관찰되지 않았다.
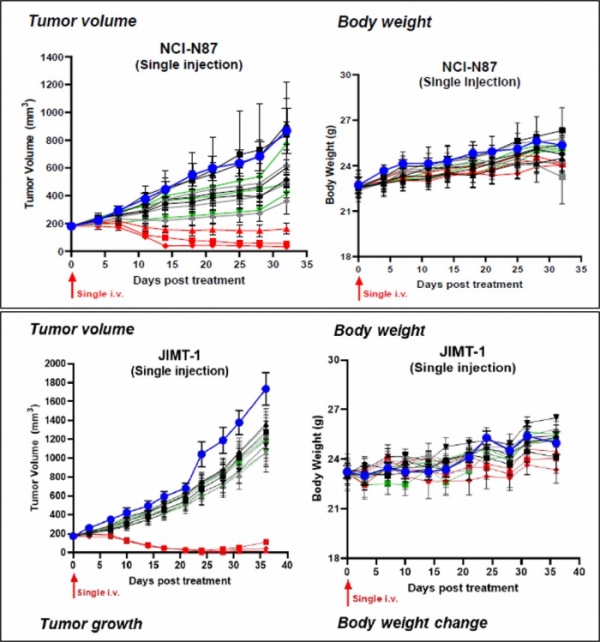
▲위암 및 유방암 마우스모델에 AP-001 투여시 항암효과 (앱티스 제공)
"ADC용 항체&페이로드 추가 발굴”
시장조사기관 아이큐비아(IQVIA)에 따르면, 미국에서 승인받은 ADC는 혈액암 치료제 7개, 고형암치료제 4개로 총 11개다.
로슈/제넨텍(Roche/Genetech)의 ‘캐싸일라(Kadcyla)’가 첫 고형암에 대해 승인받은 이후, 다이이찌산쿄/아스트라제네카(Daiichi Sankyo/Astrazeneca)의 HER2 ADC ‘엔허투(Enhertu)’, 이뮤노메딕스(Immunomedics)의 삼중음성유방암(TNBC) ADC ‘트로델비(Trodelvy)’, ADC테라퓨틱스(ADC Therapeucits)의 거대B세포림프종 ADC ‘질론타(Zylonta)’, 씨젠/젠맙(Seagen/Genmab)의 자궁경부암 ADC ‘티브닥(Tivdak)’ 등이 승인받았다.
현재 ADC에 사용하는 항체와 페이로드는 제한적인 상황이다. 일반적으로 항암제로 사용되는 항체치료제는 암세포 표면의 항원에 결합하고 면역반응을 유도해 치료하는 기전이다. ADC용 항체는 여기에 세포내부로 침투해 독성약물을 전달해야 하는 역할을 추가로 해야 하는데 항원과 항체의 특성에 따라 침투능력이 결정된다. .
혈액암을 대상으로 승인받은 ADC 항원은 CD19, CD22, CD30, BCMA 등이 있으며 고형암 대상으로는 HER2, Trop2, Nectin-4 등이 있다. 페이로드로는 미세소관 억제제인 MMAE, MMAF, DM-1, DNA 토포이소머라제 억제제인 SN-38, Dxd(deruxatecan), DNA 알킬화제인 PDB(pyrrolobenodiazepine dimer) 등이 사용되고 있어 신규 항체와 페이로드 발굴에 대한 수요가 높은 상황이다.
얀센은 최근 머사나(Mersana Therapeutics)와 신규 페이로드 ‘돌라락(DolaLock)’을 이용한 ADC 개발을 위해 계약금 4000만달러 총 10억달러 규모의 파트너십을 체결했다. 돌라락은 약물이 종양세포 뿐 아니라 주변세포에 영향을 미쳐 독성을 유발하는 주변효과(bystander effect)를 없앤 기술이다. 여기에 더해 머사나는 ADC에 6개, 12개 등 일정한 수의 페이로드를 탑재하는 기술을 보유하고 있으며, 신규 항체를 이용한 NaPi2b ADC ‘어피피타맙(upifitamab rilsodotin)’을 난소암을 대상으로 임상 1/2상을 진행 중이다.
앱티스도 신규 항체를 도입해 자체 ADC 파이프라인 구축에 나섰다. 앱티스는 지난해 12월 진스크립트(GenScript ProBio)로부터 클라우딘18.2(Claudin18.2) 항체를 도입하는 계약을 맺었다. 클라우딘18.2는 위암, 췌장암 등의 다양한 고형암에서 과발현되는 항원으로, 앱티스는 클라우딘18.2를 ADC 용도로 개발 및 상업화하는 전세계 독점적인 권리를 확보했다. 체코 소티오(Sotio), 중국 렘젠(RemeGen) 등이 클라우딘18.2를 이용한 ADC를 고형암을 대상으로 연구중이다.

















