기업
삼성에피스, '고농도 휴미라' 시밀러 1상 “동등성 확인”
기사입력 : 2022-06-02 10:32수정 : 2022-06-02 10:32
바이오스펙테이터 서윤석 기자
고농도 휴미라 바이오시밀러 ‘SB5-HC’..저농도 제형 ‘SB5-LC’와 PK·안전성 동등성 확인

삼성바이오에피스가 '고농도' 휴미라(Humira, adalimumab) 바이오시밀러 ‘SB5-HC’의 기존 저농도 제형과 동등성을 확인한 임상 1상 결과를 내놨다.
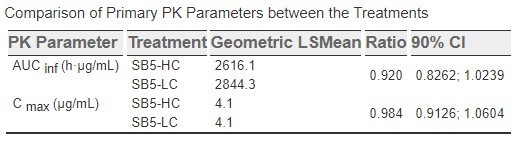
2일 삼성바이오에피스가 '2022 유럽 류마티스학회 연례 학술대회'(EULAR congress 2022)’에 제출한 초록에 따르면 고농도 휴미라 신규제형 SB5-HC(40㎎/0.4㎖)는 기존 저농도 제형 SB5-LC(40㎎/0.8㎖)와 약동학적 특성과 안전성 등이 동등한 것으로 확인됐다.
삼성바이오에피스는 187명의 건강한 남성을 대상으로 SB5-HC(93명) 및 SB5-LC(94명) 투여군으로 나눠 임상을 진행했다. 그 결과 SB5-HC, SB5-LC 투여군은 약동학적 특성에서 유의미한 차이를 보이지 않으며 생물학적 동등성을 나타냈다.
연구기간 동안 나타난 치료관련이상반응(TEAE)은 SB-HC, SB-LC 그룹에서 각각 44.7%, 51.1%로 비슷한 수준이었다. 가장 빈번하게 나타난 TEAE는 두통으로 SB-HC 10.6%, SB-LC 12.8%로 나타났다. 임상과정에서 TEAE로 인한 사망, 심각한 부작용, 연구중단은 보고되지 않았다.
(EULAR congress 2022 초록)

















