국제
BMS, 경구 ‘FXIa 저해제’ 2상 "잠재적 이점, 3상 진행"
바이오스펙테이터 서윤석 기자
FXIa 저해제 ‘밀벡시안(Milvexian)’..뇌졸중 예방 임상서 1차종결점 미충족, But 2차 뇌졸중 발생빈도 17~35% 감소·치명적출혈 없어 “3상 진행”

BMS가 2차 뇌졸중 예방약(secondary stroke prevention)으로 개발 중인 경구용 혈액응고인자 11a(Factor 11a, FXIa) 저해제(inhibitor) ‘밀벡시안(Milvexian)’이 임상 2상에서 1차종결점을 충족시키지 못했다.
그러나 BMS는 밀벡시안의 증상적 허혈성뇌졸중(symptomatic ischemic strokes) 발생 감소와 차별화된 출혈프로파일(bleeding profile) 결과에 주목해 임상 3상을 진행할 예정이다. 밀벡시안은 위약보다 증상적 허혈성뇌졸증의 상대적 위험(relative risk)을 최대 35% 감소시키고, 치명적출혈(fatal bleeding)과 두개내출혈(intracranial bleeds) 등이 위약과 차이없어 차세대 항응고제(anticoagulant)로의 가능성을 나타냈다.
BMS는 밀벡시안이 승인되면 항혈소판제(antiplatelet) ‘플라빅스(Plavix, clopodogrel bisulfate)’, 항응고제 ‘엘리퀴스(Eliquis, apixaban)’ 등과 함께 주요 항혈전제 에셋으로 50억달러 이상의 매출을 올릴 것으로 기대하고 있다.
특히 BMS의 블럭버스터 약물 중 하나인 엘리퀴스는 올해 상반기에만 64억4600만달러의 매출을 기록한 블록버스터 약물이지만, 유럽과 미국 특허가 각각 오는 2026년, 2028년 만료될 예정이다.엘리퀴스는 혈액응고인자 10a(FXa) 저해제로 심부정맥혈전증(deep vein thrombosis, DVT)과 폐색전증(pulmonary embolism, PE)의 치료 및 예방, 무릎관절·고관절 치환수술을 받은 환자의 정맥혈전색전증(venous thromboembolic event, VTE) 예방을 적응증으로 승인받았다.
BMS는 지난 28일(현지시간) FXIa 저해제 밀벡시안의 허혈성뇌졸중 임상 2상(NCT03766581, axiomatic-SSP)에서 1차종결점을 충족시키지 못한 결과를 발표했다.
발표에 따르면 BMS는 뇌졸중 환자 2366명을 2:1로 나눠 매일 1회 또는 2회 밀벡시안을 투여했다. 급성 허혈성뇌졸중(ischemic strokes) 또는 일과성 허혈성발작(transient ischemic attack, TIA)을 경험한 임상참여 환자들은 이중항혈소판 요법(dual antiplatelet therapy, DAPT)인 ‘아스피린+클로피도그렐(clopidogrel)’로 21일 동안 치료를 받았으며, 이후 22일차부터 90일까지 아스피린과 함께 위약 또는 밀벡시안을 투여받았다.
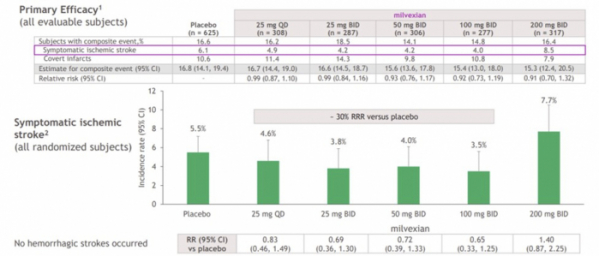
BMS는 1차종결점을 증상성 허혈성뇌졸중 발생과 MRI로 진단되는 뇌경색(brain infraction)을 합친 복합종결점(composite endpoint)에 대한 약물용량별 반응(dose response)으로 설정했다. 임상 결과 약물용량 반응은 관찰되지 않았다.
BMS는 밀벡시안을 25mg(QD, BID), 50mg(BID), 100mg(BID) 용량으로 투여한 환자들에게서 증상성 허혈성뇌졸중 발생이 줄어들어 상대적 위험(riks)이 위약 대비 최대 35% 감소한 결과를 확인했다. 구체적으로 증상성 허헐성뇌졸중 발생은 밀벡시안 25mg(QD, 308명) 투여군 4.9%(RR 95% CI: 0.83), 25mg(BID, 287명) 투여군 4.2%(RR 95% CI: 0.69), 50mg(BID, 306명) 투여군 4.2%(RR 95% CI: 0.72), 100mg(BID, 277명) 투여군에서 4.0%(RR 95% CI: 0.65)로 나타났다. 위약 투여군(625명)은 6.1%였다.
밀벡시안은 안전성 프로파일도 우수했다. 이상반응(AE) 및 심각한 이상반응(SAE)은 밀벡시안 투여군에서 각각 58.5~63.1%, 11.4~13.7%로 위약 58.5%, 13.8%와 차이를 보이지 않았다. 특히 밀벡시안의 중증출혈(severe bleeding)과 치명적출혈(fatal bleeding) 빈도는 위약과 유사했다.
BMS는 이번 임상결과를 기반으로 올해말까지 ‘밀벡시안+DAPT’ 병용요법을 이용한 2차 뇌졸중 예방임상, 급성 관상동맥증후군(acute coronary syndrome)과 밀벡시안 단독요법으로 심방세동(atrial fibrillation) 등 3개의 임상 3상을 시작할 예정이다.
항혈전제는 혈소판기능을 억제해 혈전을 막는 기전의 항혈소판제, 혈액응고를 저해하는 기전의 항응고제, 이미 발생한 혈전을 녹이는 혈전용해제(thrombolysis)로 구분된다. 밀벡시안은 경구용 FXIa 저해제로 수술 후 혈전형성을 막는 항응고제로 개발되고 있다.
무쿨 사르마(Mukul Sharma) 맥마스터대 교수이자 뇌졸중 프로그램 담당자는 “허혈성뇌졸중 또는 일과성 허혈성발작(TIA) 후 조기 뇌졸중 재발은 여전히 위험하며, 출혈로 인해 환자가 급성 비심장색전성 허혈성 뇌졸중을 앓게 되면 사용할 수 있는 항응고제는 없는 상황”이라며 “이번 결과는 밀벡시안이 이들 환자들에게 도움이 될 가능성을 보였다”고 말했다. 그는 “의료진에게 중요한 요소는 증상성 허혈성뇌졸중의 위험을 줄이는 능력”이라며 “이번 연구에서 밀벡시안은 두개내출혈 또는 치명적출혈 증가 없이 잠재적 이점을 보여줬다”고 덧붙였다.
푸닛 모한(Puneet Mohan) BMS 밀벡시안 임상개발부사장은 “이 데이터가 2차 뇌졸중 환자들에게 미충족의료수요를 해결해 줄 수 있다고 믿는다”며 “올해 후반 다양한 적응증을 대상으로 임상 3상을 시작할 예정”이라고 말했다.
BMS는 지난 2018년 얀센과 밀벡시안의 공동개발 및 상업화를 위한 파트너십을 체결했다. 개발비용과 상업화 이후 이익/손실을 공유하는 조건으로, 양사는 상세 계약내용은 공개하지 않았다.
한편 BMS는 선택적 무릎관절치환술(elective total knee replacement, TKR)을 받은 환자들에게 밀벡시안과 에녹사파란(enoxaparin) 피하투여(SC)의 효과를 비교한 임상 2상(NCT03891524)에서 정맥 혈전색전증(VTE) 발생빈도를 유의미하게 개선해 1차 종결점을 충족시켰다(DOI: 10.1056/NEJMoa2113194).
(BMS 자료 참조)













![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2277741.jpg)


![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/74/74/2277741.jpg)