오피니언
[BioS 레터]'각광받는 모달리티' TPD, 기대 이어질까?
하자인
[제3회 예비 신약개발자의 BioS 레터 공모전 수상] 표적 단백질 분해(TPD) 약물의 최근 개발동향
지난해 7월, 화이자(Pfizer)의 아비나스(Arvinas) 투자소식이 들려왔다. 아비나스의 유방암 타깃 파이프라인의 개발 및 상업화에 6억5000만달러의 계약금 및 3억5000만달러의 지분투자, 총 10억달러에 달하는 규모였다. 곧이어 다음달인 8월에는 바이엘(Bayer)이 비비디온 테라퓨틱스(Vividion Therapeutics)를 총 20억달러에 인수한다고 알렸다. 비비디온 역시 아비나스와 마찬가지로 표적 단백질 분해제를 개발하는 미국 소재의 바이오 회사다. 바로 작년에 이어진 굵직한 뉴스에서 볼 수 있다시피, 최근 5년간 지속적으로 증가하고 있는 투자현황은 표적 단백질 분해가 현재 글로벌 제약사가 가장 관심을 갖는 분야 중 하나임을 보여준다.(표 1)
![▲출처: From drug target inhibition to degradation: a TACtical strategy. Biopharm Deal (2022) [1]에서 발췌 및 재구성](http://img.etoday.co.kr/pto_db/2022/09/600/20220905140558_1794139_1145_878.jpg)
▲출처: From drug target inhibition to degradation: a TACtical strategy. Biopharm Deal (2022) [1]에서 발췌 및 재구성
표적 단백질 분해(Targeted protein degradation; TPD)란?
표적 단백질 분해는 E3 리가아제(ligase) 또는 라이소좀(lysosome) 등과 같이 기존의 세포내 단백질 분해시스템을 하이재킹(hijacking)함으로써 원하는 단백질의 분해를 유도한다. 기존의 단백질 저해제가 점유-기반(occupancy-based) 기전을 갖는데 반해, 표적 단백질 분해제는 사건-기반(event-driven) 기전에 의한 약효를 보인다.(그림 1) 다시 말해 표적 단백질 분해제는 표적 단백질의 분해를 유발하는 복합체 형성에 반복적으로 참여함으로써 기본적으로 촉매와 같은 역할을 수행할 수 있다.
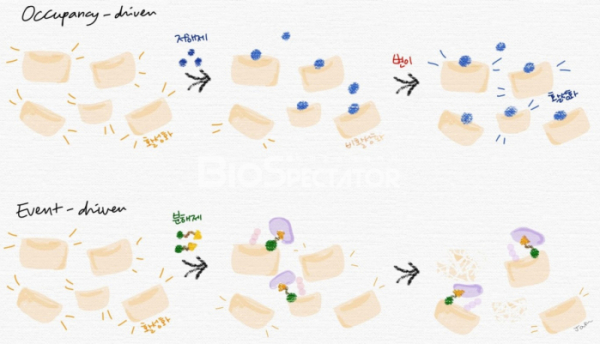
▲그림 1. 점유-기반(occupancy-driven) 및 사건-기반(event-driven) 기전 비교.
점유-기반 기전을 갖는 저해제(예: 인산화효소 저해제)는 표적 단백질의 활성 부위 또는 결합할 경우 단백질의 비활성화 구조를 안정적으로 유지하는 알로스테릭 부위에 결합함으로써 단백질의 기능을 억제한다. 이런 부위에 변이가 발생할 경우 저해제는 더 이상 표적 단백질에 결합하지 못한다. 또는 저해제가 결합한 상태로도 활성화되는 추가적인 변이를 가진 표적 단백질이 발현할 수도 있으며, 다른 단백질과의 상호작용을 통해 보완적(compensatory)으로 신호를 전달할 가능성도 있다. 사건-기반 기전을 갖는 분해제는 표적 단백질에 결합, 단백질 분해 시스템을 하이재킹하여 해당 단백질의 분해를 유도한다. 결합해있던 표적 단백질이 분해되면 분해제는 세포 내에 존재하는 또다른 표적 단백질에 결합하는 과정을 반복할 수 있다. 변이가 일어날 수 있는 표적 단백질 자체가 분해되어 없어짐으로써 추가적인 변이가 일어날 확률이 낮아질 것이라 기대해 볼 수 있다.
유비퀴틴-프로테아좀(ubiquitin-proteasome) 시스템을 기반으로 한 E3 리가아제 단백질과 표적 단백질의 결합을 유도하는 분해제는 크게 2가지로 분류할 수 있다. 현재 표적 단백질 분해제의 대표적인 플랫폼인 프로탁(proteolysis-targeting chimera; PROTAC)은 표적 단백질에 결합하는 리간드(warhead)와 E3 리가아제에 결합하는 E3 리가아제 리간드(E3 ligase ligand), 그리고 이 두 물질을 접합하는 링커(linker)로 이루어진 이기능성(bifunctional) 물질이다.[2] 이에 반해 흔히 분자 접착제(molecular glue)로 통칭되는 물질 중 대표적인 예시인 탈리도마이드(thalidomide) 계열의 약물은 E3 리가아제 세레블론(Cereblon; 이하 CRBN)에 결합하여 본래 CRBN의 기질이 아닌 새로운 기질(neosubstrates)과의 상호작용을 통해 이 기질들의 분해를 유도하는 단일결합(monovalent) 물질로 분류된다.[3]
위의 유비퀴틴-프로테아좀 시스템뿐 아니라 최근에는 라이탁(lysosome-targeting chimaera; LYTAC) 및 오토탁(autophagy-targeting chimera; AUTOTAC)과 같은 약물도 활발히 연구되고 있다. 최근의 표적 단백질 분해 연구 현황과 관련하여 유수의 저널에서 리뷰 논문이 발표되었다.[4]
2000년대에 처음 연구 발표된[5] 표적 단백질 분해제는 이제 10건 이상의 임상이 진행중이다.(표 2) 현재 임상 진행중인 분해제는 모두 유비퀴틴-프로테아좀 시스템을 기반으로 CRBN 혹은 폰 히펠-린다우(von Hippel-Lindau; VHL)와 같은 E3 리가아제를 활용한다(*일부 파이프라인은 하이재킹하는 E3 리가아제 미공개 상태).
![▲출처: PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov (2022) [6]에서 발췌 및 재구성.](http://img.etoday.co.kr/pto_db/2022/09/600/20220905140643_1794140_1134_946.jpg)
▲출처: PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov (2022) [6]에서 발췌 및 재구성.
선두 파이프라인 임상 현황
1) ARV-110 (Bavdegalutamide), 아비나스
안드로겐 수용체(androgen receptor; AR)는 전립선암(prostate cancer)의 주요 타깃 중 하나다. 전립선암 환자들의 전체생존기간은 안드로겐 차단요법(androgen deprivation therapy; ADT)과 엔잘루타마이드(enzalutamide)와 같은 안드로겐 수용체 저해제를 이용한 항-안드로겐 치료법으로 증가할 수 있으나, 결국 저항성이 나타나는 문제점이 여전히 존재한다. 질병이 진행됨에 따라 대다수의 환자에게서 안드로겐 수용체 유전자의 증폭이나 변이가 관찰됨에 따라 안드로겐 수용체는 전이성 암의 주요 요인으로 지목되고 있다.[7] 전립선암에서의 그 중요성을 반영하듯 안드로겐 수용체는 현재 개발중인 표적 단백질 분해제 중 가장 많은 수를 차지하고 있는 타깃이다 – 아비나스 뿐 아니라 브리스톨 마이어스 스큅(Bristol Myers Squibb), 아큐타 바이오테크(Accutar Biotech), 킨토르(KINTOR), 프로테오반트(Proteovant) 및 히노바 파마슈티컬스(Hinova pharmaceuticals) 등에서 현재 안드로겐 수용체 분해제를 개발 중이다.
안드로겐 수용체를 분해하는 아비나스의 ARV-110은 임상 2상(ARDENT trial)에 진입하여 현재 표적 단백질 분해제 중 가장 앞선 단계에 있는 물질이다. 2020년 12월, 아비나스는 전이성 거세저항성 전립선암 남성을 대상으로 한 ARV-110 임상 1/2상 중간결과를 발표했다.[9] 안드로겐 수용체 T878X/H875Y 변이가 있는 5명의 환자 중 2명(40%)에서 PSA(전립선암 특이적 항원, prostate specific antigen)가 50% 이상 감소하였으며, 1명은 부분반응(PR)이 확인됐다. T878X/H875Y 변이가 없는 환자에서도 PSA 감소는 확인되었으며, 임상2상 권장용량(RP2D)은 420 mg 경구투여로 결정되었다. 이를 기반으로 ARDENT 임상 2상은 바이오마커 서브그룹별로- T878X/H875Y 변이, WT/기타, L702H/AR-V7 변이, 그리고 치료전력에 따라 분석 가능하게끔 설계했다.
2022년 2월 ASCO Genitourinary Cancers 심포지엄에서 업데이트 발표된 바에 따르면, 각 서브그룹에서의 PSA50(PSA수치가 50% 이상 감소한 군)은 T878X/H875Y(n=8)에서 75%, WT/기타(n=44)에서 11%, L702H/AR-V7(n=25)에서 4%, 그리고 치료전력이 1번 이하인 그룹(n=27)에서 22%로 나타났다.[10, 11] L702H/AR-V7 및 치료전력이 적은 그룹에서 T878X/H875Y 변이를 가진 환자를 모두 모아 분석할 경우(n=28), PSA50은 46%로 나타났다. 아비나스의 발표에 따르면, 치료전력이 많은 환자군(heavily pretreated, n=77)과 적은 환자군(less pretreated, n=27)의 안드로겐 수용체 변이 타입별 비율은 비슷했으며, PSA 감소 수치도 두 군에서 비슷하게 나타났다.
차후 발표되는 임상결과를 더 지켜보아야 하겠지만, 현 시점에서 주목할 만한 점은 안드로겐 수용체 변이 타입이 PSA 감소 수치와 상관 관계가 있는 것처럼 보인다는 점이다. 전임상 모델에서도 L702H나 AR-V7 변이를 가진 경우, ARV-110에 의한 표적 분해가 확인되지 않았던 것이 임상에서도 해당 서브그룹에서의 낮은 PSA50 수치로 비슷하게 나타났다. 엔잘루타마이드, 아팔루타마이드(apalutamide), 또는 다로루타마이드(darolutamide) 등은 안드로겐 수용체의 리간드-결합 도메인(ligand-binding domain; 이하 LBD)에 결합하여 안드로겐 수용체를 저해하며, 현재 ARV-110 역시 해당 도메인에 결합한다.(그림 2) AR-V7 변이의 경우, C-말단의 LBD가 없는(절단된) 상태로 발현되기에 분해제의 효능이 낮게 나타나는 것으로 연구자들은 해석하고 있다.
![▲그림 2. 안드로겐 수용체 주요 변이. NTD: N-terminal transactivation domain, DBD: DNA-binding domain, HR: hinge region, LBD: ligand-binding domain, AR-V7: 안드로겐 수용체-V7.(참조: Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer. Nat Rev Cancer (2015) [12])](http://img.etoday.co.kr/pto_db/2022/09/600/20220905141228_1794147_894_242.jpg)
▲그림 2. 안드로겐 수용체 주요 변이. NTD: N-terminal transactivation domain, DBD: DNA-binding domain, HR: hinge region, LBD: ligand-binding domain, AR-V7: 안드로겐 수용체-V7.(참조: Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer. Nat Rev Cancer (2015) [12])
L702H 변이를 타깃으로 하는 아비나스의 후속 파이프라인 ARV-766는 임상 1상 진행중에 있다. 안드로겐 수용체는 이량체(dimer)로 기능하며, AR-V7은 full-length 안드로겐 수용체(이하 AR-FL)와 결합하여 이종이량체(heterodimer)를 이룰 수 있다. 회사 측에서는 ARV-110 또는 ARV-766이 다양한 변이를 가진 AR-FL을 분해할 경우, AR-V7/AR-FL 이종이량체를 감소시킴으로써 AR-V7에 의한 전립선암 진행을 저해할 가능성을 조심스럽게 제기한 바 있다.[13] 하지만 최근 연구결과에 따르면, AR-V7 변이는 단일체(monomer) 상태로 핵으로 이동할 수 있으며, AR-V7 동종이량체(homodimer)로 유전자 발현과 DNA 복구 시스템을 조절할 수 있는 것으로 나타났다.[14] 현재 아비나스는 AR-V7을 직접 타깃으로 하는 파이프라인을 추가 개발하고 있다.
2) ARV-471, 아비나스
에스트로겐 수용체(estrogen receptor; ER)를 표적으로 하는 ARV-471은 아비나스가 화이자와 글로벌 파트너쉽을 맺고 ER+/HER2- 진행성/전이성 유방암 환자를 대상으로 임상 2상(VERITAC trial)을 진행 중인 약물이다.
전임상 데이터에서 ARV-471은 풀베스트란트(fullvestrant) 대비 저용량에서 우월한 효과를 보여주었다.[15] 10 mg/kg에서 약 99%, 30 mg/kg에서 106%의 암 성장 저해를 보여주었으며, 에스트로겐 수용체 단백질은 각각 79%, 88% 감소했다(풀베스트란트 200 mg/kg 투여 시, 약 63%의 단백질 저해 효과 확인). 또한 CDK4/6 저해제인 팔보시클립(Palbociclib)과 병용한 경우에도 풀베스트란트+팔보시클립 병용보다 뛰어난 암 저해 효과가 나타났다. ARV-471 + 팔보시클립 병용 투여한 모든 실험 동물(n=10)에서 암 크기가 80% 이상 감소하였다.
현재까지 업데이트 발표된 임상 1상 데이터에 의하면 ARV-471를 500mg까지 투여했을 때, 에스트로겐 수용체가 평균 64%, 최대 89%까지 분해되는 것이 확인되었다. 이는 이전에 보고된 풀베스트란트에 의한 에스트로겐 수용체 분해치(40~50%)보다 높은 수준이다.[16, 17] 평가 가능한 총 47명의 환자에서 40%의 임상적 이점(clinical benefit rate; *완전반응(CR), 부분반응(PR), 안정병변(SD)의 합)를 보였다. 3명의 환자에서 부분반응이 확인되었다. 총 60명 환자 중 최대 700 mg까지 용량제한독성은 나타나지 않았다.
VERITAC 임상 2상은 ARV-471 단독으로 진행되며 추가적으로 팔보시클립과 병용으로 1차 치료제의 가능성을 탐색하는 임상이 진행 중이다. 2022년 하반기에는 ARV-471 임상 데이터가 추가적으로 업데이트될 예정이다.[18]
3) KT-474, 카이메라/사노피
인터루킨-1 수용체-관련 키나아제 4(interleukin-1 receptor-associated kinase 4, 이하 IRAK4)는 IL-1R/TLR 신호전달계의 주요 인산화효소로 하위 기질을 인산화하는 기능과 더불어 신호전달 복합체 형성의 스캐폴드(scaffold)로 기능한다. IRAK4를 통한 신호 전달을 차단함으로써 하위 염증 반응 활성화 기전을 저해할 수 있다. 기존의 저해제가 IRAK4의 인산화 기능만을 저해하는 데 반해, 분해제는 스캐폴드 기능까지 차단할 수 있어 개발사 측에서는 보다 우월한 효과를 기대하고 있다.
IRAK4를 타깃으로 하는 KT-474는 카이메라와 사노피가 공동 개발중인 약물이다. KT-474의 면역 세포 내 DC50는 2.1 nM로 임상단계에 있는 IRAK4 저분자 저해제(PF-06550833)보다 우월한 IL-6 저해능을 보여주었다.
건강한 사람을 대상으로 한 임상 1상(NCT04772885)의 파트 A/B에서 심각한 부작용은 보고되지 않았으며, 50, 100, 200 mg 용량 투여군에서 평균 95~98%의 IRAK4 단백질 감소를 확인하였다. 주요 사이토카인은 50% 이상 저해되었으며 100 mg 용량 투여군에서는 최대 85%까지 저해되었다. 현재 카이메라는 화농성한선염(Hidradenitis Suppurativa) 및 아토피 피부염(Atopic Dermatitis) 환자를 포함한 파트 C를 진행중이다.[20]
4) FHD-609, 포그혼 테라퓨틱스
BAF 복합체는 ATP-의존적인 크로마틴 리모델링 복합체 중 하나로 다양한 유전자의 발현을 조절한다. 활막육종에서는 BAF 복합체를 이루는 서브유닛 중 하나인 유전자 SS18의 전좌(translocation)로 SS18-SSX 융합 단백질이 발현된다. 이 구조변이가 일어날 경우, BAF 복합체를 이루는 또다른 서브유닛 BRD9(bromodomain-containing protein 9)이 활막육종세포의 생존에 필수적으로 작용한다.[21] 즉 BRD9을 저해할 경우, 활막육종의 성장을 막을 수 있다.
포그혼 테라퓨틱스는 유전자 발현에 필수적인 크로마틴 조절 복합체인 BAF 복합체의 주요 인자를 타깃으로 한 파이프라인을 다양하게 개발중이다. 이 중 BRD9 특이적 분해제인 FHD-609는 진행성 활막육종 적응증에 대해 임상 1상 진행중이다(NCT04965753).
SS18-SSX2 변이를 지닌 SY01 활막육종 세포주 유래 이종이식(cell line-derived xenograft, 이하 CDX) 모델에 FHD-609를 일주일에 한번 복강 투여하였을 경우, 암 성장을 저해하고 지속적인 BRD9 분해를 확인한 바 있다. 또한 SS18-SSX1 변이가 있는 ASKA CDX 모델에서는 FHD-609를 일주일에 두 번 0.5 mg/kg 또는 2 mg/kg 용량으로 정맥 투여한 경우, 이포스파마이드(ifosfamide) 또는 파조파닙(pazopanib) 투여보다 우월한 저해 효과를 보여주었다.
FHD-609는 아직 구조가 공개되지 않은 상태로 하이재킹하는 E3 리가아제 역시 비공개 상태이며, 격주 정맥 투여로 임상 디자인되어 있다. FHD-609의 안전성을 가늠해볼 수 있는 최초 임상 데이터는 2023년 발표될 예정이다.
향후 전망
표적 단백질 자체를 분해하여 질병 유발 단백질을 제거할 수 있다는 개념은 많은 연구자들의 관심을 불러모았다. 최근 10년간 PROTAC 또는 TPD 키워드로 발표되는 논문의 수는 기하급수적으로 증가하고 있다. 간략하게 개발 현황을 살펴본 바와 같이, 표적 단백질 분해제는 초기 임상에서 기대할 만한 결과를 보여주었으며 전임상 단계의 물질들도 속속 임상 진입을 앞두고 있다.
이러한 장점과 함께 표적 단백질 분해제 개발에 해결해야 할 과제가 존재한다. 표적 단백질의 암세포 특이적 변이가 없을 경우, 표적 단백질 분해제는 정상 세포 내에 존재하는 표적 단백질 역시 분해할 수 있다. 표적 단백질의 기능이나 분해제의 분해능에 따라 on-target 독성의 위험성을 내포하고 있는 셈이다. 연구자들은 암세포 특이적 분해제 개발을 위해 암세포/조직 특이적으로 발현되는 E3 리가아제를 발굴하고자 탐색하고 있다.
현재 임상 단계에 있는 표적 단백질 분해제의 대다수는 고형암/혈액암 치료제에 치중되어 있지만, 다양한 적응증에 대한 탐색연구도 진행중이다. 특히 노화/퇴행성 뇌질환의 주요 인자인 타우(Tau), 알파-시뉴클레인(a-Synuclein) 등과 같이 응집(aggregation)되어 신경세포의 파괴를 유발한다고 알려진 단백질이 매력적인 타깃으로 여겨진다. 향후 표적 단백질 분해제의 치료 영역이 얼마나 확장될 수 있을지도 개발사의 주요 관심사 중 하나이다.
전세계적으로 인플레이션과 경기침체의 예측이 공존하는 가운데, 글로벌 제약사의 대규모 감축 소식에 제약바이오 업계의 신약개발 역시 영향을 받을 수 있다는 우려가 제기되고 있다. 이 가운데에서도 표적 단백질 분해제에 대한 연구는 지속적으로 활발하게 발표되고 있으며, 임상에 진입하는 약물의 수도 증가하고 있다. 불안 섞인 낙관주의 속에서 선두 파이프라인의 임상 결과 업데이트가 과연 최초의 표적 단백질 분해제 승인의 근거가 되어줄 수 있을지 모두가 주목하고 있다.
Reference
[1] Nasir, M., Bak, P., Gauldie, S. & Leo, C. From drug target inhibition to degradation: a TACtical strategy. Biopharm Deal (2022)
[2] Corson, T. W., Aberle, N. & Crews, C. M. Design and Applications of Bifunctional Small Molecules: Why Two Heads Are Better Than One. ACS Chem Biol (2008)
[3] Sasso, J. M. et al. Molecular Glues: The Adhesive Connecting Targeted Protein Degradation to the Clinic. Biochemistry (2022)
[4] Alabi, S. B. & Crews, C. M. Major advances in targeted protein degradation: PROTACs, LYTACs, and MADTACs. J Biol Chem (2021)
[5] Sakamoto, K. M. et al. Protacs: chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation. Proc Natl Acad Sci USA (2001)
[6] Bekes, M., Langley, D. R. & Crews, C. M. PROTAC targeted protein degraders: the past is prologue. Nat Rev Drug Discov (2022)
[7] Salami, J. et al. Androgen receptor degradation by the proteolysis-targeting chimera ARCC-4 outperforms enzalutamide in cellular models of prostate cancer drug resistance. Commun Biol (2018)
[8] Arvinas, ARV-110 AACR Presentation, AACR Annual Meeting (2021)
[9] Arvinas, Press Release (Dec 14 2020)
[10] Arvinas, ASCO Genitourinary Cancers Symposium (2022)
[11] Arvinas, Press Release (Feb 17 2022)
[12] Watson, P. A., Arora, V. K. & Sawyers, C. L. Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer. Nat Rev Cancer (2015)
[13] Arvinas, FORM 10-K, SEC (DEC 2020)
[14] Roggero, C. M. et al. A detailed characterization of stepwise activation of the androgen receptor variant 7 in prostate cancer cells. Oncogene (2021)
[15] Arvinas, ARV-471 AACR Presentation, AACR Annual Meeting (2021)
[16] Robertson, J. F. et al. A randomized trial to assess the biological activity of short-term (pre-surgical) fulvestrant 500 mg plus anastrozole versus fulvestrant 500 mg alone or anastrozole alone on primary breast cancer. Breast Cancer Res (2013)
[17] Kuter, I. et al. Dose-dependent change in biomarkers during neoadjuvant endocrine therapy with fulvestrant: results from NEWEST, a randomized Phase II study. Breast Cancer Res Treat (2012)
[18] Arvinas, Arvinas Corporate Presentation (April 2022)
[19] Kymera, KT-474 Phase 1 clinical trial update (June 2021)
[20] Kymera, Kymera Corporate Presentation (June 2022)
[21] Brien, G. L. et al. Targeted degradation of BRD9 reverses oncogenic gene expression in synovial sarcoma. Elife (2018)
[22] Foghorn Therapeutics, Foghorn Therapeutics IR (2022)













![[인사]제일약품, 임상의학본부장에 조민희 이사](https://img.etoday.co.kr/crop/77/77/2077123.jpg)


![[인사]제일약품, 임상의학본부장에 조민희 이사](https://img.etoday.co.kr/crop/74/74/2077123.jpg)
