기업
애스톤, ‘HSP90 항암백신’ 고형암 1상 “내년 결과”
바이오스펙테이터 서윤석 기자
고대 안암병원서 진행 HSP90 항암백신 후보물질 ‘AST-021p’, 내년 결과 기대..신규 항원·에피토프 발굴·개발 플랫폼 ‘Th-Vac’ 구축

애스톤사이언스(Aston Science)가 항암백신을 위한 신규 항원과 에피토프(epitope) 발굴 및 개발 플랫폼 Th-Vac과 현재 고형암 임상 1상을 진행하고 있는 HSP90 항암백신 후보물질 ‘AST-021p’의 개발 진행상황을 업데이트했다.
Th-Vac 플랫폼은 항암백신으로 개발할 수 있는 신규 항원과 에피토프를 in silico 모델링을 통해 발굴하고, in vitro 및 in vivo 수준에서 검증하는 기술이다.
현재 임상1상을 진행 중인 AST-021p은 4개의 용량 중 마지막 투여용량만 남아 내년 중 임상1상 결과를 확인할 수 있을 것으로 애스톤은 기대하고 있다. AST-021p는 애스톤이 고려대에서 2019년 도입해 글로벌 개발 권리를 확보한 펩타이드 기반 항암백신 후보물질이다.
신헌우 애스톤사이언스 대표는 8일 서울 코엑스에서 열린 ‘코리아 라이프사이언스 위크, 우량 제약·바이오기업 IR’에서 “신규 항암백신을 발굴할 수 있는 플랫폼과 임상1상에서 10여년이상 안전성과 효과를 확인한 AST-301과 임상1상 진행 중인 AST-p021 등 다수의 항암백신 파이프라인을 보유하고 있다”며 “향후 항체약물접합체(ADC), 면역관문억제제 등과 병용 효과를 기대할 수 있는 만큼 관련 기업과의 파트너십을 기대하고 있다”고 말했다.
애스톤사이언스는 올해 1월 시리즈C로 270억원을 유치하며 현재까지 총 480억원을 투자받았다. 애스톤은 내년 코스닥시장 상장을 목표로 준비를 하고 있다.
항암백신은 암환자에게 암세포에서 발현되는 항원을 투여해 체내 면역시스템을 활성화시켜 항암효과 및 암의 재발을 막는 기전이다. 항암백신에서는 암세포의 항원과 T세포 활성에 영향을 미치는 에피토프를 찾는 것이 중요하다.
애스톤은 리드 파이프라인인 HER2 저발현 유방암 항원백신 후보물질 ‘AST-301’의 개발에 적용된 기술에 in silico 모델링을 결합해 신규 항원 및 에피토프를 발굴하고 in vitro/in vivo 수준에서 면역원성을 분석하는 Th-Vac 플랫폼을 구축했다. 애스톤은 이를 통해 면역반응을 증가시키는 항암백신 후보물질과 제1형당뇨병(T1D) 등에 적용할 수 있는 면역반응을 억제하는 후보물질 등을 개발할 수 있을 것으로 기대하고 있다.
HER2 저발현 유방암 환자를 대상으로 임상이 진행중인 AST-301은 HER2의 ICD(intracellular domain)을 암호화하는 DNA 기반 항암백신 후보물질이다. 애스톤에 따르면 AST-301은 항원 특이적인 CD4 T세포의 활성화를 유도하며, 장기간 범용투여가 가능하고, 피내투여(ID) 방식으로 월 1회씩 3회 접종하면 되는 장점을 가진다.
애스톤은 현재 AST-301을 삼중음성유방암(TNBC)을 적응증으로 미국·호주·대만 등에서 임상2상을, HER2 양성 위암을 적응증으로 대만 임상2상을 진행하고 있다.
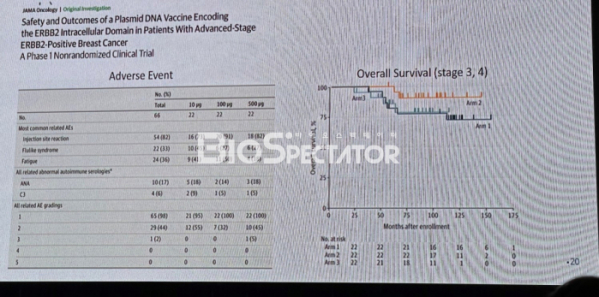
AST-301은 애스톤이 지난 2020년 매리 디시스(Mary L. Disis) 워싱턴대 교수 연구팀으로부터 도입한 약물이다. 최근 디시스 교수 연구팀은 AST-301의 10년에 걸친 임상 1상(NCT00436254) 결과를 국제학술지 ‘JAMA oncology’에 게재했다(doi:10.1001/jamaoncol.2022.5143).
논문에 따르면 연구팀은 표준치료를 마친 HER2 양성 진행성 유방암 환자 66명을 3그룹으로 나눠 AST-301을 저용량(10㎍), 중간용량(100㎍), 고용량(500㎍)으로 투여해 10년 이상에 걸쳐 안전성과 효과를 평가했다. 저용량, 중간용량, 고용량군의 추적 관찰기간 중앙값은 각각 118.6개월, 99.7개월, 73.5개월이었다.
그 결과 연구팀은 AST-301 투여군에서 대부분 1~2등급의 경미한 부작용을 확인했으며, 3등급이상 부작용은 2%(1명)에 불과해 장기 안전성을 확인했다. 가장 흔하게 나타난 부작용은 주사부위 반응 82%, 독감유사증상 33%, 피로 36% 등으로 나타났다.
효능 측면에서 3가지 용량의 AST-301 투여군은 모두 전체생존기간(OS)과 무진행생존기간(PFS) 중앙값에 도달하지 않았으며, 각 용량군간 통계적으로 유의미한 차이는 없었다. 특히 임상 2상에 사용된 AST-031 중간용량군은 90%이상의 OS를 보였다.
신 대표는 “AST-301은 임상 1상에서 10년 이상 추적연구를 통해 안전성이 증명됐다”며 “AST-301은 위약군과 효과를 비교하는 임상 2상을 진행해 2025년에는 결과를 확인할 수 있을 것“이라고 말했다.
한편 애스톤은 난소암을 대상으로 AST-201의 글로벌 임상 2상을 준비하고 있다. 이외에도 난소암을 적응증으로 하는 다중항원 항암백신 후보물질 'AST-202', 차백신연구소로부터 도입한 TLR2/3 타깃 면역증강제 후보물질 'AST-065' 등을 연구하고 있다.
(애스톤 발표자료)

















