오피니언
한미 '올리타' 밀어낸 '타그리소', 임상중 사망발생은?
바이오스펙테이터 김성민 기자
임상2상서 약물부작용 관련 사망 13명 발생...직접적 원인은 4명=간질성 폐렴(3명), 폐렴
베링거인겔하임이 기술을 사들였다가 중도에 개발을 중단한 한미약품의 '올리타(성분명 올무티닙)'는 아스트라제네카의 '타그리소(성분명 오시머티닙)'와 경쟁구도에 있었다. 이 두 약물은 치료제가 없는 3세대 폐암치료제로 글로벌 시장에서 상당한 관심을 끌었다.
하지만 타그리소는 개발에 속도를 내면서 멀찌감치 앞서 나가 시장에 먼저 진입한 반면 올리타는 베링거인겔하임의 임상중단 결정으로 상당한 타격을 입은 상태다. 그렇다면 타그리소는 어떤 약물이기에 올리타를 제치고 앞서 나갈 수 있었을까? 그리고 타그리소는 임상시험 도중에 부작용은 발생하지 않았을까? 올리타 임상중단 발표이후 타그리소의 장점, 부작용 등에 궁금증이 커지고 있다.
먼저 올리타의 경쟁력 하락을 야기한 타그리소는 어떤 치료제일까?
타그리소는 올리타와 같은 3세대 EGFR TKI계열 약물이다. EGFR(상피세포성장인자수용체, Epidermal growth factor receptor)은 타이로신 수용체(tyrosine receptor)의 한 종류로 세포표면에 발현하고 있으며 EGF 혹은 TGFα가 결합할 경우 세포성장, 혈관생성 등과 같은 다양한 신호전달 과정에 관여한다고 알려져 있다. 그런데 비소성폐암을 비롯한 일부 암에서 EGFR에 생긴 변이(mutation)로 인해 EGFR이 과활성화된 상태로 유지되는 것이 문제로 작용한다.
폐암의 80%를 차지하는 비소세포폐암에 쓰이는 1세대 타쎄바, 이레사는 EGFR 활성에 영향을 주는 물질로 약효는 좋지만 투약 후 1년 내에 높은 내성을 나타낸다는 한계가 있다. 타그리소는 3세대 EGFR TKI로 기존 약물에 대해 내성이 생긴 비소세포폐암 환자 중 T790M변이가 일어난 환자를 대상으로 한다.
◇변이양성 비소세포폐암 치료제로 급부상하는 타그리소
아스트라제네카는 1세대 폐암 치료제인 이레사에 이어 3세대 치료제 타그리소를 개발하면서 폐암치료제 시장 강자 입지를 굳혀가는 모양새다. 1차 치료 이후 T790M변이가 일어난 환자군과 뇌 전이 환자군에서도 임상적 효과를 증명했다. 타그리소는 1차치료제로서의 효과와 안전성도 이레사보다 월등히 뛰어난 것으로 평가받고 있으며, 이레사와 비교해 2배 가까운 무진행생존기간을 보이고 있다.
아스트라제네카는 지난 7월 타그리소의 EGFR T790M 변이 양성 비소세포폐암 치료효과를 담은 임상3상시험 내용을 발표했다. 400명 환자를 대상으로 타그리소의 2차 치료 효과와 안전성을 평가한 결과, 표준치료법 대비 우수한 무진행생존기간을 보였고 객관적 반응률에서도 차이를 보이며 전체생존기간을 포함한 임상시험 평가는 계속 진행 중이다. 이중 글로벌 임상 3상인 AURA3에 참여한 한국인은 72명으로, 임상 2상에선 167명으로 41%를 차지한다.
타그리소는 2015년 11월 FDA 승인을 시작으로 국내에서도 올해 5월 식약처로부터 시판 허가를 획득했다. 타그리소 한달 약가가 990만원대로 가격적 단점을 극복하기 위해 ASTRIS라는 임상을 통해 환자들에게 무료로 지원하고 있으며, 내년 상반기경 급여 획득 전까지 계속될 전망이다.
◇타그리소, EGFR-TKI 계열 약물로의 부작용은?
타그리소의 부작용은 어떻게 나타났을까. 지난해 12월 유럽의약국(EMA)이 발표한 임상 2상 결과에서 타그리소의 부작용 발현율과 내용이 상세히 소개됐다.
EGFR-TKI 계열 약물로 치료 중이거나 또는 치료경험이 있는 EGFR T790M 변이 양성 비소세포폐암 환자 411명을 대상으로 진행된 2개의 임상, AURA Extension과 ARUA 2의 통합분석(Pooled Analysis)에 따르면 타그리소 80mg 복용에 따른 부작용은 다음과 같다.
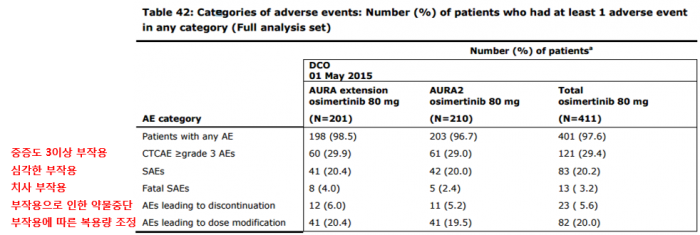
▲타그리소 복용에 따른 부작용 분류 (%)출처: EMA
부작용 등급은 일반적인 이상반응 범주(CTCAE, Common Terminology Criteria for Adverse Events 4.0)를 기준으로 경미한 부작용부터 사망까지 1~5등급으로 분류되는데, 통합분석에 따르면 대부분 환자들은 1급 경증(mild) 부작용과 2급 중등증(moderate) 부작용은 각각 30.4%, 37.7%를 나타냈다.
EGFR 관련 약에서 가장 흔히 보고되는 부작용은 설사(diarrhea), 발진(rash), 피부건조(dry skin), 손발톱주위염(paronychia)으로 대부분 1급, 2급에 해당한다. 타그리소 복용 환자군에서 가장 흔하게 나타난 부작용은 설사로 투여 환자 중 42.3%에서 보고됐다. 발진(23.8%), 피부건조(23.1%), 손발톱주위염(17.5%) 순으로 기존 EGFR 치료제에서 알려진 부작용과 크게 다르지 않았다.
이외 EGFR 계열 약물에서 흔히 보고되는 부작용은 피부이상반응이다. 피부이상반응은 크게 발진/여드름, 소양감, 피부건조증, 박탈 피부염으로 나뉜다. 213명(51.8%)의 환자에서 1급 피부 부작용이 나타났으며, 2급은 31명(7.5%), 3급은 2명(0.5%)의 환자에서 보였다. 3급에 해당하는 피부 부작용은 각각 반점상구진과 홍반증세로 그 이상의 심각한 피부 부작용은 없었다.
일반적으로 심각한 약물부작용을 판단할 때 CTCAE를 기준으로 3급 이상 등급에 주목하는데, 3급은 중증(severe), 4급은 생명을 위협하는 수준(life-threatening)으로 분류된다. 타그리소 복용에 따른 3급 부작용을 보인 환자는 25.5%, 4급은 1.2%이다. 3급 이상 부작용에서 가장 큰 비중을 차지하는 것은 호흡기 질환, 감염, 혈액∙림프계 질환이다.
기존 EGFR TKI 계열 약물과 비교해 타그리소에서 높은 빈도로 나타나는 부작용은 간질성폐질환(Interstitial lung disease, ILD) 혹은 IDL 계열 질환이다. 11명 환자(2.7%)가 이와 같은 부작용을 보였으며, 증상이 나타나기까지의 중간 값은 83일이다. 이중 7명이 아시아인으로 11명중 3명이 3급 이상 중증도를 보였으며, 4명(0.7%)의 환자가 사망했다.
부작용을 나누는 기준은 CTCAE의 3등급 이상 외에 심각한 부작용(SAEs, serious adverse effect)과 환자가 죽음에 이르는 치사부작용(fatal SAEs)이 있다. 먼저 심각한 부작용에 해당하는 결과는 어땠을까? 83명(20.2%)의 환자에서 이 단계의 부작용이 나타났으며 이중 호흡기 질환은 7.3%, 감염은 6.1%를 차지, 가장 흔한 질환은 폐렴과 폐색전증이었다.
◇임상2상 시험서 타그리소 부작용 사망 13명 보고
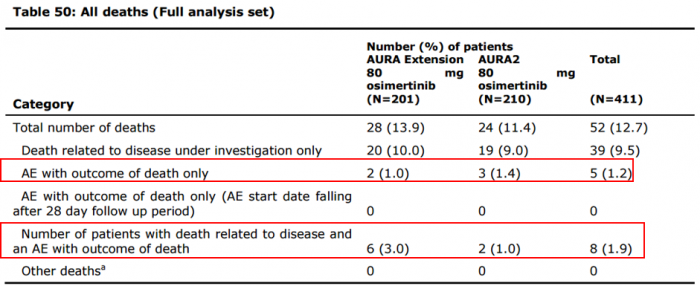
▲전체 사망자출처: EMA
임상 2상 진행 중 사망 환자는 총 52명 발생했고 이중 39명은 질병 진행으로 사망했다. 약물 복용과 관련돼 치사부작용으로 사망했다고 집계된 환자는 총 13명이다. 사망의 원인이 부작용인 경우가 5건, 질병 진행과 부작용이 복합적으로 작용해 사망한 환자는 8명이다.
약물 부작용으로 사망한 13명 중 타그리소와 인과관계가 밝혀진 사망 환자는 총 4명이다. 3명은 간질성폐질환(ILD), 1명은 폐렴(pneumonitis)으로 각각 사망했다.
업계 관계자는 타그리소 복용에 따른 사망자에 대해 “재발성, 전이성 등 말기 암환자를 대상으로 했기에 질병 진행으로 사망자가 나올 수 있다”라며 “환자 면역력이 약해진 상태에서 감염에 의한 폐렴이 나타나기도 한다”고 전했다.
한편 한미약품 '올리타'의 경우 730여명을 대상으로 진행한 임상2상시험에서 중증 피부이상반응으로 인한 사망사례가 2건 보고됐고 올리타와의 인과관계가 밝혀진 사망은 1건으로 조사됐다.













![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2277741.jpg)


![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/74/74/2277741.jpg)