오피니언
셀비온, ‘PSMA 방사성’ 전략과 국내 1/2상 결과는?
바이오스펙테이터 김성민 기자
[KDDF 우수과제 발표회]셀비온 “플루빅토 사각지대 국내시장 타깃” 177Lu-DGUL 개발 전략과 임상1/2상 중간 결과 공개..내년 하반기 mCRPC 2상 완료

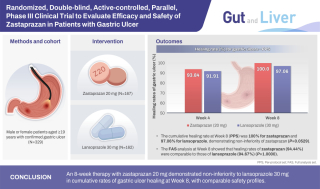
▲이송진 셀비온 연구소장(CTO)가 지난 12일 서울 드래곤시티호텔에서 KDDF 10대 우수과제 발표회에서 기술설명을 진행하고 있다, 출처=바이오스펙테이터
셀비온(CellBion)이 내년 하반기 방사성의약품(radiopharmaceutical therapy, RPT) 리드 프로그램인 PSMA 타깃 ‘177Lu-DGUL’의 임상2상을 마치고, 이 결과를 바탕으로 오는 2025년을 목표로 국내 조건부허가를 추진할 계획이다.
셀비온은 올해 7월 식약처로부터 전립선암 치료제로 177Lu-DGUL의 글로벌 혁신제품신속심사(GIFT) 대상으로 지정되면서, 이를 위한 발판을 마련한 상태다.
최근까지만 해도 방사성의약품은 미지의 영역이었다. 기존의 방사선치료는 환자의 몸 밖에서 방사선(radiation)을 쬐어 국소부위 암을 치료하는 컨셉이었다면, 방사성의약품은 이보다 효능이 강한 알파(α), 베타(β)와 같은 동위원소(isotope)를 항체에 접합시켜 전신투여로 암조직 특이적으로 방사성동위원소를 전달해 암을 사멸시키는 컨셉이다. 항체-약물접합체(ADC)와 유사한 컨셉으로, 방사성동위원소를 페이로드(payload)로 이용하는 것이다.
이러한 가운데 셀비온의 177Lu-DGUL과 같은 기전의 약물로, 지난해 미국 식품의약국(FDA)으로부터 노바티스의 거세저항성 전립선암(mCRPC) 치료제로 ‘플루빅토(Pluvicto, 177Lu-PSMA-617)’가 시판허가를 받았다. 플루빅토는 공급이슈에도 불구, 올해 3분기 누적 매출액 7억700만달러를 올리면서 시장에 빠르게 침투하고 있다. 그러나 여전히 국내에서는 미충족 수요가 있는 시장이며, 셀비온이 이 틈을 치고 들어가겠다는 목표이다.... <계속>