기업
스카이, '개량 CsA1' 안구건조증 국내2상 “눈물량 개선”
바이오스펙테이터 서윤석 기자
생체이용률 향상 ‘모아시스’ 기술 적용 사이크로스포린A(CsA1) ‘SCAI-001’..기준선 대비 눈물량 변화 유의미하게 개선

스카이테라퓨틱스(SCAI Therapeutics)는 안구건조증 치료제 후보물질 'SCAI-001'의 임상2상에서 눈물량 개선효과를 확인했다고 20일 밝혔다.
회사에 따르면 이번 임상은 부산대병원을 포함한 국내 11개 임상시험기관에서 중등도 이상의 안구건조증 환자 116명을 대상으로 SCAI-001을 투여해 유효성과 안전성을 분석했다. 또 기존 안구건조증 치료제인 '레스타시스(Restasis®)'를 양성 대조군으로 사용해 비열등성을 평가했다.
1차 종결점으로는 12주차시점에서 기준선 대비 눈물량 변화를, 2차종결점으로는 기준선 대비 안구불편감지수(OSDI)의 변화, 각막염색검사(corneal staining score), 결막염색검사(conjunctival staining score) 점수 등으로 설정했다.
임상 결과 셔머테스트(Schirmer test)로 측정한 12주차시점의 눈물량 변화(LS Mean)는 SCAI-001 0.01%(40명), 0.02%(37명) 투여군에서 각각 평균 3.15mm, 3.39mm로 기준선 대비 통계적으로 유의미하게 증가했다(p<0.05). 레스타시스 투여군에서는 평균 2.41mm로 나타났다. 셔머테스트는 눈물 분비량을 분석하는 검사로, 종이를 눈꺼풀 밑에 두고 5분간 젖은 종이의 길이를 측정한다.
다음으로 12주차시점에 안구불편감지수(OSDI)는 SCAI-001 0.01%와 0.002% 투여군에서 각각 평균 13.74점, 23.12점 감소해 기준선 대비 통계적으로 유의미하게 개선됐다(p<0.05). 각막염색검사 점수는 SCAI-001 0.01%와 0.02% 투여군에서 각각 평균 1.38점, 1.54점, 결막염색검사 점수는 각각 평균 1.53점, 1.62점 감소하며 기준선 대비 통계적으로 유의미한 차이를 나타냈다(p<0.05)
SCAI-001 투여군에서 발생한 안과적 부작용은 눈 통증, 시야 흐림, 눈 자극 등이었으며, 모두 사이클로스포린 점안제에서 이미 알려진 부작용이었다.
스카이테라퓨틱스는 오는 3월 제주도에서 열리는 대한안과학회 학술대회를 비롯한 국내외 안과관련 학술대회에서 이번 임상2상의 결과를 발표할 예정이다.
SCAI-001은 스카이테라퓨틱스의 생체이용률 향상 플랫폼 기술인 모아시스(MOASIS®) 기술을 안구건조증 치료물질인 사이클로스포린A(cyclosporine A, CsA1)에 적용한 안구건조증 점안제 후보물질이다. 기존 치료제인 레스타시스에 사용된 유효물질 0.05% 대비 20~40%만의 유효물질을 포함하면서 부형제는 90%까지 줄인 게 특징이다.
스카이테라퓨틱스 관계자는 “SCAI-001 점안액은 객관적징후, 주관적 증상 모두에서 기준선 대비 통계적으로 유의미한 개선을 보였으며, 안전성 측면에서 레스타시스와 유의미한 차이가 없음을 확인했다”며 “이번 결과를 통해 모아시스® 플랫폼 기술을 검증하게 됐으며, 유효성 지표에서 일관성 있는 결과를 확보해 향후 임상3상에 탄력을 받을 수 있을 것으로 예상된다”고 말했다.
한편 스카이테라퓨틱스는 지난 2022년 시리즈B로 334억원의 투자를 받은 바 있으며, 현재 황반변성 치료제를 모아시스® 기술을 적용한 점안제로 개발하고 있다.
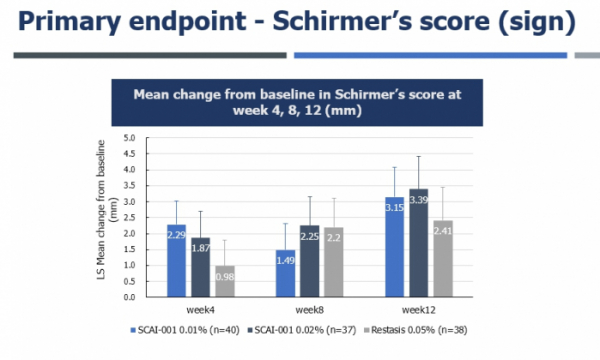
▲셔머테스트로 측정한 기준선 대비 눈물량 분석(스카이테라퓨틱스 제공)



















