피플
"'간세포 3D 배양기술'로 신약 약물대사·독성 예측"
바이오스펙테이터 이은아 기자
[바이오파마 테크콘서트 기술소개③] 곽종영·김소희 아주대 교수, 투명막 나노섬유 활용해 초대간세포 장기간 생존·기능유지 확인
“일반적으로 신약후보물질 탐색단계에서 약물의 대사·독성 확인을 위해 세포 실험을 진행하는데 간세포는 평면배지에서 배양이 까다롭고 세포 고유의 기능 유지가 어려운 한계가 있습니다. 우리 연구팀은 나노섬유를 이용한 3D 세포 배양 시스템을 개발해 초대간세포(Primary hepatocyte)를 장기간 배양하고 기능이 오래 유지되도록 했습니다. 특히 간세포에 필요한 영양분을 생성하는 섬유아세포와 분리한 채 공배양해 실제 간조직과 유사한 환경이 구현돼 신약개발 초기단계에서 활용도가 높을 것으로 기대됩니다."
곽종영 아주의대 교수(의학과)와 김소희 아주대 교수(약학과)는 자체 개발한 간세포 3차원(3D) 배양기술에 대해 이렇게 소개했다. 연구팀은 두 가지 나노섬유 구조체를 이용한 간세포와 섬유아세포를 분리·공동배양 할 수 있는 시스템을 구현해 간세포 생존기간과 기능유지 효과를 확인했다.
곽 교수는 오는 26일 오후 1시부터 서울 더플라자호텔 지하1층 그랜드볼룸에서 개최되는 '2017 제2회 바이오파마 테크콘서트'에서 '간세포 생존 및 기능 유지 3D 세포 배양 기술'이라는 주제로 발표할 예정이다.
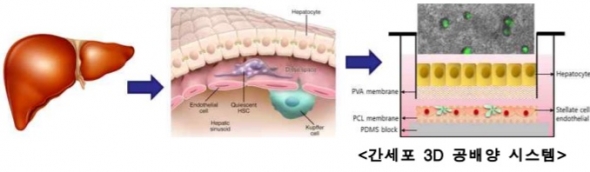
◇ 간세포 배양의 한계 극복위한 ‘3D 배양, iPS 세포’ 이용
신약 후보물질 탐색 단계에서 약물의 효능과 독성을 예측하기 위해 세포를 이용한 인비트로(in vitro) 과정을 거치게 된다. 간세포는 약물의 대사와 독성을 확인하기 위해 사용되지만 그동안 배양이 까다로워 어려움을 겪었다.
곽 교수는 “간 조직에서 바로 추출한 초대간세포(primary hepatocyte)를 평면배지에서 배양하면 생존기간은 약 이틀정도다. 특수배지나 성장인자 등 영양분을 많이 넣어 간세포 배양에 성공한다 하더라도 세포 고유의 기능이 유지되는 기간은 고작 2일 정도로 짧다”며 기존 간세포 배양에 대한 난관을 지적했다. 이런 이유로 in vitro 연구결과는 실효성 여부에 대한 논란이 일어왔다.
이런 문제점을 개선하기 위해 최근 3D 세포배양 기술이 각광받기 시작했다. 3D 세포배양 기술은 세포의 원래 모양과 특성을 유지할 수 있어 보다 정확한 약물 스크리닝 결과를 제공할 것으로 기대되는 분야다.
그 중 3D 프린터를 이용해 간세포, 혈관세포, 기술세포로 이뤄진 인공 간세포를 만든 미국 생명공학회사 ‘오가노보(Organovo)’가 대표적 예다. 42일 이라는 장기간동안 간세포의 생존과 기능을 유지할 수 있어 2014년부터 신약개발에 활용하도록 판매하고 있다. 그러나 곽 교수의 설명에 따르면 3D 프린팅 기술로 인공 간조직을 3D 배양하기 위해서는 셀(cell) 프린팅 기술과 바이오잉크 개발이 선행돼야한다는 번거로움이 있다.
간세포 분화에 성공한 유도만능줄기세포(iPS)를 이용하는 방법도 있다. 곽 교수는 “iPS에는 미분화세포가 포함돼있어 이를 분리해내야 하는 단점이 있다. 게다가 iPS에서 분화된 간세포가 섬유아세포로 탈분화하는 상피-간엽 전이(epithelial-mesenchymal transition, EMT) 현상이 일어나 제대로 된 실험결과를 얻기가 어렵다”고 설명했다. EMT 현상이 일어나면 상피세포로서의 고유 기능을 소실하기 때문이다.

▲곽종영 아주의대 교수(의학과), 김소희 아주대 교수(약학과)
◇ 나노섬유 기반 3D 배양으로 실제 간조직과 유사 환경 구현
곽 교수 연구팀은 두 가지 나노섬유를 이용해 실제 간조직과 유사한 간세포층을 구현한 3D 간세포 공배양 기술을 개발했다.
그는 “보통 하이드로젤을 이용한 3D 배양은 초대간세포와 배양시 필요한 영양분을 생성하는 섬유아세포를 함께 공배양한다. 이때 두 세포가 서로 엉켜 자라게 된다. 우리가 개발한 3D 세포배양 기술은 두 가지 나노섬유를 이용해 간세포와 섬유아세포가 분리된 채로 공배양하는 환경을 구현해 간세포만 관찰하거나 기능을 분석할 수 있다”고 설명했다.
연구팀이 사용한 나노섬유는 폴리비닐 알코올(PVA, polyvinyl alcohol)와 후코이단을 함유한 폴리카프로락톤(PCL, polycaprolactone)이다. 기존의 PVA는 높은 친수성, 투과성, 생체적합성, 생분해성 등의 장점을 가지지만 물에 대한 용해도가 높아 세포배양용 소재로 이용되는데 한계가 있었다.
연구팀은 화학적인 방법을 처리해 물에 녹지 않으면서도 투명성을 유지한 PVC와 후코이단 이라는 다당류 성분을 함유해 세포 부착능이 개선된 PCL을 개발했다.
곽 교수는 “이 시스템은 PVA 나노섬유 구조체에는 간세포를, PCL에는 섬유아세포를 각각 따로 분리해 공동배양 할 수 있다”고 말했다. 그는 이어 “나노섬유 3D 배양기술로 간세포와 섬유아세포를 공배양 후 7일째에 80% 간세포 생존율을 확인했다. 간세포는 최대 20일까지도 생존했다. 간세포 기능을 확인하기 위해 관찰한 알부민, E-카데닌(E-cadherin) 등의 단백질 발현도 5일째 계속 유지되는 것을 관찰했다”며 “무엇보다 장기 배양 후 일어나는 상피-간엽 전이(EMT)를 예방할 수 있다”고 강조했다. 초대간세포를 장기간동안 배양하면서 기능도 유지할 수 있게 된 것이다.
장점은 더 있다. 그는 이어 “PVA 투명막을 통해 형광으로 염색하지 않아도 실시간 간세포의 성장 분석이 가능하다”며 “또한 사용자가 쉽고 저렴하게 배양 시스템을 구현할 수 있다”고 덧붙였다. 배양기간 동안 간세포의 성능, 형태 유지 등 간 기능 분석이 간편해졌다는 얘기다.
◇ 3D 간세포로 약물간 상호작용, 대사, 독성 예측 가능
간세포 3D배양 기술은 약물의 독성·효능 예측 단계에서 활용성이 크다. 곽 교수와 공동연구를 진행하는 김소희 아주대 약학과 교수는 기술의 활용성에 대해 다음과 같이 설명했다.
김 교수는 “나노섬유 기반 초대간세포 3D 배양시스템은 ▲약물간 상호작용을 분석 ▲간 수송체 기능적 흡수(uptake) 분석 ▲약물 유도 간 손상 분석해 독성 파악 ▲알코올성지방간 in vitro 모델 구축 등에 활용될 수 있다”고 설명했다.
약물대사효소 유도반응 시 약물 처리 후 약 2~3일 후에 대사효소 유도가 나타나는데 기존 배양 시스템에서는 정확한 데이터를 얻을 수 없었다. 나노섬유 기반 3D 배양시스템으로 장기간 간세포를 배양하면서 정확한 약물대사효소 유도반응이 가능할 것으로 예측하고 있다.
김 교수는 “약물대사 분석시 흡수 수송체(uptake transporter)가 많은 간에서 실험을 하는데 이 배양시스템은 도움이 많이 될 것이다”며 “인비보(in vivo)와 가까운 인간 초대세포(primary cell)에서 약물 예측을 분석하면 약물 스크리닝에도 활용도가 높을 것이다”고 강조했다.
곽 교수와 김 교수는 앞으로 장기간 초대간세포 생존 및 기능유지가 가능한 나노섬유 기반 3D 배양세포를 이용해 약물 효능·독성 예측 분석에도 구현될 수 있는지 확인하는 연구를 수행할 계획이다. 또한 간세포의 3D 배양을 상용화하는 것이 목표라고 밝혔다.














![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)




