오피니언
2018년 '美 바이오시밀러 시장' 주목해야하는 이유
바이오스펙테이터 이은아 기자
"美 공보험 정책개정으로 우호적 환경 기대, 2년내 6종 특허만료".."레미케이드, 리툭산, 허셉틴 시밀러시장 경쟁 본격화"..“휴미라도 유럽서 첫 개시”
바이오시밀러는 지난해 역대 최다 제품이 유럽과 미국의 허가 관문을 통과하며 대세를 굳히는 분위기를 연출했다. 지난 2017년 유럽과 미국에서 허가받은 바이오시밀러 제품은 각각 9개, 5개로 총 14개였다. 글로벌의약품 상위 매출 10개 중 7개 제품의 바이오시밀러가 승인됐으며, 유럽에서 휴미라, 리툭산, 허셉틴의 첫번째 바이오시밀러가, 미국에서는 아바스틴, 허셉틴 바이오시밀러가 처음으로 허가를 받았다. 또 60여개 이상의 바이오시밀러 후보물질이 시판허가 신청을 제출했거나 후기임상 단계로 개발 중이다.
특히 주목할 만한 성과는 미국 시장에서다. 미국은 늦은 바이오시밀러 규제 도입, 특허 만료기간, 오리지널 개발사의 견고한 방어벽 등의 문제로 유럽에 비해 바이오시밀러의 진입 장벽이 높았다. 보건당국으로부터 허가받은 바이오시밀러 제품이 38개인 유럽과 달리 미국은 유럽보다 10년 늦은 2015년에 최초의 바이오시밀러 '작시오(Zarxio, Sandoz)'가 모습을 드러낸 것도 이 때문이다. 현재까지 승인받은 제품은 단 9개로 그 중 5개가 지난해 FDA로부터시판허가를 받았다. 지난해 4월 레미케이드 바이오시밀러 ‘렌플렉시스(Renflexis, 삼성바이오에피스)를 시작으로 휴미라 바이오시밀러 ’실테조(Cyltezo, 베링거인겔하임)', 아바스틴 바이오시밀러 ‘엠바시(Mvasi, 암젠/엘러간)’, 허셉틴 바이오시밀러 ‘오기브리(Ogilivi, 밀란/바이오콘)', 레미케이드 바이오시밀러 '익시피(Ixifi, 화이자)’가 차례로 승인됐다.
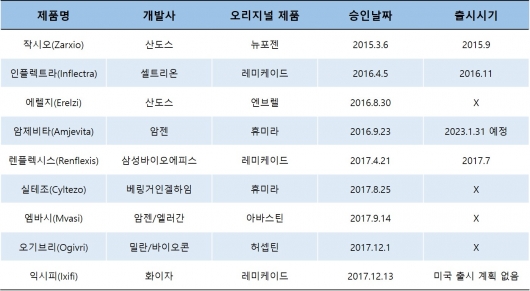
▲미국 바이오시밀러 승인 목록 (출처: 각 사, 바이오스펙테이터 구성)
바이오시밀러의 미국시장 진출과 더불어 올해 1월부터 시행된 미국 공공의료보험 청구 정책 개정안은 미국 내 바이오시밀러 성장을 가속화시킬 것으로 기대되고 있다. 더욱이 글로벌 의약품 상위 매출을 차지하는 6개 오리지널 제품이 2019년 내 특허가 만료돼 2018년 바이오시밀러 개발 경쟁은 미국에서 더욱 본격화될 전망이다. 그동안 바이오시밀러 시장 진입 속도가 늦었던 미국에서 2018년 바이오시밀러의 성장을 눈여겨봐야 하는 이유다.
바이오스펙테이터는 미국 공보험 개정안 이후 기대되는 변화, 바이오시밀러 개발현황, 오리지널사와의 특허 소송 문제, 넘어야할 과제 등을 살펴보면서 2018년 바이오시밀러 시장에서 주목해야할 점을 집중 조명해봤다.... <계속>













![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/77/77/2277741.jpg)



![[인사]종근당 계열사, 2026년 임원승진 인사](https://img.etoday.co.kr/crop/74/74/2277741.jpg)