국제
길리어드, '1세대 유전자가위' 상가모와 Next CAR-T 공동개발
바이오스펙테이터 김성민 기자
상가모의 ZFN기술 적용한 동종유래(allogeneic) 및 자가유래(autologous) 항암제 개발협약...'임상서 검증되고 있는 정밀성+효율성+선택성 가진 ZFN기술 높게 평가, 향후 10개 이상 제품 공동개발'

유전자가위 기술을 적용한 차세대 CAR-T(Chimeric antigen receptor T cells) 치료제 개발경쟁이 본격화되고 있다.
CAR-T 분야의 선두주자인 길리어드의 카이트는 지난 22일 상가모테라퓨틱스(Sangamo therapeutics)가 보유한 1세대 유전자가위기술인 '징크핑거뉴클레아제(ZFN, Zinc finger nuclease)' 기술을 동종유래(allogeneic) 및 자가유래(autologous) 항암제 개발에 적용하는데 대한 독점권리를 확보했다고 밝혔다. 길리어드는 선입금으로 계약금으로 1억5000만달러를 현금지급했으며, 향후 10개 이상의 제품을 완성하는데 대한 마일스톤으로 최대 30억1000만달러를 지급하는 계약을 체결했다.
길리어드의 카이트는 가장 먼저 'off-the-shelf' CAR-T 개발에 착수하게 된다. 기성품과 같이 환자에 바로 투여가능한 CAR-T다. 현재 시판된 두개의 CAR-T는 모두 환자 자신의 T세포를 이용하기 때문에 제조까지 평균 3주의 시간이 소요되며, 1회 투여에 4억~5억원에 이르는 천문학적 비용이 든다는 한계점이 있다.
John Milligan 길리어드 대표는 "우리는 상가모의 ZFN이 최적의 유전자편집 플랫폼을 제공한다고 믿는다"며 "상가모와의 협약을 통해 암환자가 병원에서 더 용이하게 접근할 수 있는 차세대의 동종 유래 및 자가유래 세포치료제를 개발할 것이다"고 밝혔다.
길리어드는 일찍이 올해초에 열린 'JP모건 헬스케어컨퍼런스'에서 차세대 CAR-T 개발을 위해 셀디자인랩 인수에 이은 다음 계획으로 동종유래 CAR-T 개발의 필요성을 피력한 바 있다. 이러한 기대감을 반영해 3세대 CRISPR 유전자가위 기술을 보유한 회사들의 주가가 일제히 상승하기도 했다. 업계는 길리어드가 크리스퍼가 아닌 1세대 유전자가위를 선택한 것에 대해 의외라는 평가다. 길리어드가 상가모의 1세대 유전자가위를 선택한 배경은 뭘까?
업계 전문가는 "현재 유전자가위 분야를 선도하는 기술과 새롭게 부흥하는 기술의 이슈로 본다"며 "크리스퍼는 ZFN에 비해 다양한 질병을 치료하는 것에 훨씬 효율적이라고 생각돼 주목받고 있지만 아직 임상에 들어갈만큼의 충분한 시간을 거치지 않았다"는 설명이다. 올해초 크리스퍼 작용의 핵심요소인 Cas9 단백질이 인간에 면역원성을 가진다는 연구결과가 발표되면서 논란이 불거지기도 했다. 길리어드는 더 안정된 기술로 리스크를 낮추는 전략을 선택한 것이다.
덧붙여 아직까지 크리스퍼 기술을 둘러싼 특허분쟁이 끝나지 않은 상황에 ZFN 특허를 독점하고 있는 상가모가 더 매력적으로 평가된 것으로 보인다. 크리스퍼 특허를 보유한 기업의 공동개발 현황을 보면 Editas는 주노테라퓨틱스(셀진이 인수), Intella는 노바티스, CRISPR Therapeutics와 툴젠은 자체적으로 CAR-T 프로그램을 구축하고 있다. 한국에서는 툴젠이 크리스퍼 특허를 선점했으며 미국, 유럽지역에서는 아직 결론이 나지 않은 상황이다.
상가모의 ZFN는 임상에서 검증되고 있는 기술이다. 크리스퍼의 등장으로 상대적으로 ZFN이 뒤쳐지는 것처럼 보였지만 20년의 기술개발 끝에 상가모는 최근 연이은 마일스톤을 달성하면서 1년내 꾸준한 주가상승을 보이고 있다. 상가모는 화이자와 기존의 혈우병A 치료제개발에 이어 루게릭병(ALS) 적응증에 ZFN 기술을 적용하는 치료제개발에 대한 협약을 추가로 체결하기도 했다.
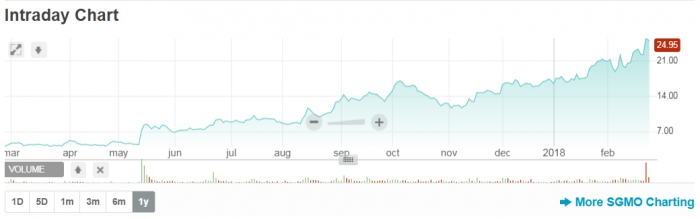
▲나스닥에서 1년 동안의 상가모 주가추이 그래프
상가모는 미국에서 가장 먼저 ex vivo, in vivo 임상에 들어간 기업으로 현재 5개의 혈액질환에서 치료제의 임상1/2상 프로그램을 진행하고 있다. 상가모는 혈우병A, 혈우병B, 리소좀축적질환(LSD)인 MPSI(mucopolysaccharidosis type I), MPSII가 적응증에서 임상을 진행하고 있다. 시트오브호프 연구진과는 HIV/AIDS 환자를 대상으로 연구자 임상을 진행하고 있다. 반면 아직까지 미국, 유럽지역에서 크리스퍼 기술로 임상에 들어간 예가 없다는 점에서 대비되는 모습이다.
길리어드는 상가모를 선택하게 된 이유로 "ZFN은 크리스퍼 및 다른 유전자편집 플랫폼과 비교해 정밀성(precision), 효율성(efficacy), 특이성(specificity) 측면에서 우수하다"고 설명했다. 상가모는 신규링커로 DNA 결합모듈을 확실히해 타깃서열에 대한 정밀성을 300배 높였으며, 신규 dimer 구조로 유전자변형 효율을 99.5%로 구현했다. 핵심적인 잔기를 교체함으로써 인산화접촉 튜닝을 통해 off-target 이슈는 1000배 감소했다.
상가모는 동종유래 CAR-T 제조플랫폼을 구축하고 있는 단계다. 상가모는 경쟁자와 비교해 높은 효율의 CAR-T 세포를 얻을 수 있음을 증명했다. 현재까지 밝힌 바에 따르면 ZFN 기술을 이용할 경우 TCR 제거(93%), HLA-class I에 속하는 β2M 제거(96%), 체크포인트 유전자 제거(93%), 그밖에 타깃삽입(target insertion) 효율은 91%을 보였다. 4개의 유전자편집을 모두 거친 T세포를 얻을 확률은 76%에 이른다.
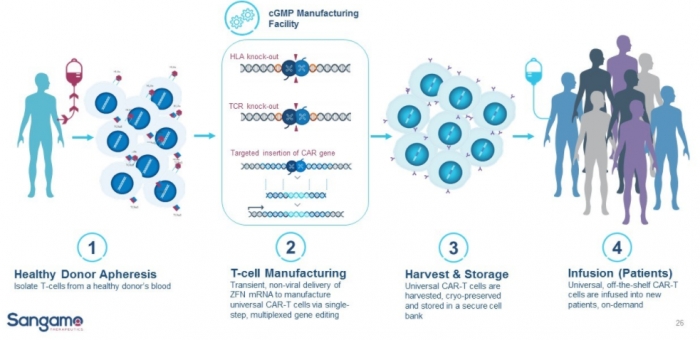
▲상가모 off-the-shelf CAR-T 제작과정
그러면 현재 글로벌 동종유래 CAR-T 개발현황은 어떨까? 선두주자인 셀레틱스는 2세대 유전자가위인 탈렌(Talen)을 이용해 TRAC, CD52를 제거한 UCART 플랫폼을 기반으로 CD19, CD22, CD123을 겨냥한 치료제의 임상1상을 진행하고 있다. 임상은 화이자와 공동으로 진행하고 있다. 셀리틱스는 현재까지 80% 이상의 유전자편집 효율과 6bp까지 정밀한 편집이 가능하다고 밝혔다. 그밖에 주노테라퓨틱스, Poseida Therapeutics, Mustang Bio 등이 동종유래 CAR-T 플랫폼을 구축하고 있다.
동종유래 치료제개발 외에도 유전자가위 기술의 적용범위는 무궁무진하다. 대표적으로 Tmunity 테라퓨틱스가 유전자가위로 기능이 향상된 CAR-T, TCR-T 치료제를 개발하고 있다. 국내에서는 툴젠이 diacylglycerol kinase(DGK)을 제거한 CAR-T 플랫폼을 구축하고 있으며, 큐로셀은 PD-1 및 PD-1 내성 면역관문분자를 동시에 없앤 CAR-T를 개발하고 있다.






![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/74/74/2071974.jpg)







![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2071974.jpg)



