국제
로슈, NSCLC 대상 테센트릭 병용투여.."임상3상서 OS↑"
바이오스펙테이터 김성민 기자
IMpower150 임상3상 4기 비소세포폐암(NSCLC) 대상 '테센트릭+아바스틴+화학요법' 병용투여군에서 OS 연장효과..."1차 치료제로서 가능성 제시"

최근 가장 주목받는 PD-(L)1 약물을 둘러싼 경쟁에서 로슈의 '테센트릭(Tecentriq)'이 존재감을 드러내고 있다. 로슈는 4기 비소세포폐암(NSCLC)에서 진행한 IMpower150 임상3상에서 전체생존률(OS)이 연장됐다고 지난 26일 밝혔다. 로슈는 이들 환자군에서 1차치료제로서 승인받겠다는 목표다. 임상3상의 1차 총족점으로 OS, 무진행생존기간(PFS)이 설정됐다.
임상 그룹은 크게 3개로, 핵심 임상군인 테센트릭+아바스틴+화학요법 병용투여군에서 OS 연장효과가 있었다. 특히 로슈는 비소세소폐암 환자에서 PD-L1 발현과 상관없이 생존에 이득이 있었다고 강조했다. 로슈는 아바스틴+화학요법만 병용한 환자군과 비교했을때 OS가 "유의미하게 높아졌다"고 밝혔다.
한가지 주목할 점으로 이번 중간분석에서 테센트릭+화학요법 그룹에서 유의미한 차이는 없었다. 즉 3가지 그룹에서 아바스틴과 테센트릭이 병용투여된 경우에만 차이가 있다는 뜻이다. 로슈는 계획대로 최종분석을 진행할 계획이라고 밝혔다.
지난해 로슈는 IMpower150 스터디의 결과로 테센트릭+아바스틴+화학요법 병용투여군과 아바스틴+화학요법 병용투여군을 비교했을때 암발생률이 38% 줄어든다고 발표한바 있다. 그러나, 해당환자군에서 키트루다가 1차 치료제로 승인받은 것을 고려하면 OS, PFS에서 강력한 효능을 입증해야된다고 거론됐었다. 이번 임상결과에서 테센트릭의 병용군에서 OS 연장효과가 있다는 것을 보여줬기에 의미가 있다고 볼수 있다.
Sandra Horning 제넨텍 임상개발총괄(CMO) 책임자는 "IMpowe150 study가 초기치료를 받은 진행성 비소세소폐암 환자에서 임상적으로 의미있는 생존기간 연장을 보여줬다"며 "이러한 결과는 테센트릭과 아바스틴을 병용투여를 뒷받침하는 증거로 우리는 추가데이터를 글로벌 보건당국에 제출할 예정으로 환자에 가능한 빠르게 치료옵션을 제공하길 원한다"고 밝혔다.
로슈는 이번달에 4기 편평(squamous) 비소세포폐암를 대상으로한 IMpower131 스터디에서도 테센트릭+아바스틴+화학요법 병용투여군에서 PFS에 유의미한 차이를 확인했다고 밝힌바 있다. 로슈는 테센트릭의 비소세포폐암 시장에서 추진력을 얻고 있으며, 테센트릭+아바스틴 병용투여 임상은 30건에 이른다.
현재까지 5개의 PD-(L)1 약물이 시판된 가운데, 사실상 키트루다, 옵디보가 비소세포폐암 시장을 점유하고 있는 상황이다. 그중에서도 키트루다가 비소세포폐암 1차 치료제로 시장을 넓혀가면서 매출이 꾸준히 증가하고 있다. 반면 테센트릭은 키트루다, 옵디보의 비소세포폐암 시장과 비교해 1/3에 머물러 있는 수준으로 다양한 병용투여임상 세팅을 통해 시장차를 좁히기 위해 노력하고 있다. 실제 두 약물과 비교해 테센트릭의 최근 매출액에 큰 변화가 없는 상황이다. 최근 로슈의 비소세포폐암 병용임상결과의 추이에 주목해야 되는 이유다.
한편 지난해 옵디보의 매출액은 50억달러, 키트루다는 38억달러, 테센트릭은 5억달러였다. 분석기관인 Cowen&Co에 따르면 키트루다, 옵디보, 테센트릭은 2019년까지 NSCLC 시장을 30%까지 차지할 것으로 예측했다.
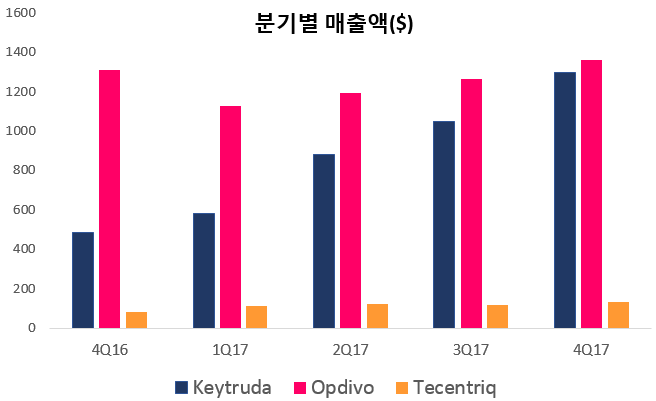
▲키트루다, 옵디보, 테센트릭 매출액추이. 각사 자료참조해 바이오스펙테이터 재구성.


















