국제
암세포만 사멸시키는 'RNA 편집' RIBOTAC 개발
바이오스펙테이터 이은아 기자
스크립스연구팀, 'RNA 타깃 저분자화합물+RNA 분해효소'로 암세포만 선택적 사멸 확인
▲스크립스연구소 플로리다캠퍼스 연구팀은 암세포를 사멸시키는 RNA 편집도구를 개발했다(출처: Journal of the American Chemical Society, 2018, doi: 10.1021/jacs.8b01233)
DNA를 자르는 CRISPR-Cas9 편집도구에 이어 RNA를 절단하는 저분자화합물 기반 RNA 편집도구가 개발됐다. RNA 타깃 저분자화합물에 RNA 분해효소(RNase)를 부착해 암세포만 특이적으로 사멸시키는 접근법이다. 단백질이 아닌 저분자화합물을 사용하기 때문에 경구용 약물로 개발이 가능하다는 장점이 있다.
유전체(Genome)의 약 2%는 단백질을 암호화하지만 게놈의 70~80%가 RNA로 전사되므로 잠재적으로 훨씬 많은 수의 표적을 제공한다. 그러나 RNA는 크기가 작고 안정성이 낮기 때문에 그동안 다루기 힘들었다.
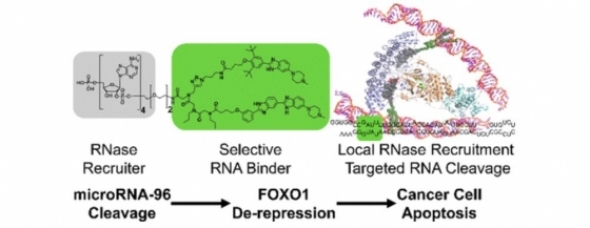
스크립스연구소 플로리다캠퍼스 연구팀은 유방암을 일으키는 마이크로RNA(miRNA) 유전자에 대해 디자인된 리보핵산 가수분해효소 타깃팅 키메라인 'RIBOTAC(ribonuclease-targeting chimera)'가 정상세포는 손상시키지 않으면서 악성 세포만 사멸시키는 것을 확인했다.
연구팀은 지난 2016년 작고 안정한 RNA 결합 파트너와 저분자화합물 약물에 결합할 수 있는 계산방법인 ‘InfornaTM’를 고안해 삼중음성유방암을 포함한 암세포의 증식을 촉진하는 miRNA-96에 선택적으로 결합하는 Targaprimir-96을 개발했다.
이번 연구에서는 Targaprimir-96와 RNA 분해효소인 RNaseL을 결합시켜 효능을 확인한 것이다. RNaseL은 감염된 RNA 바이러스를 자르면서 항바이러스 면역반응을 일으키는 RNA 분해효소로, 모든 세포에서 소량 생산되는데 RNA 바이러스에 감염되면 그 양이 상향 조절된다.
Targaprimir-96와 RNaseL로 구성된 RNA 표적 복합체는 암 세포에 적용했을 때 표적 oncogenic miRNA-96를 선택적으로 잘라냈다. 그러자 삼중음성유방암 세포에서 세포사멸(apoptosis)을 일으키는 전사인자인 FOXO1의 억제가 효과적으로 차단되지 않았다. 다시 말해, mir-96를 잘라냄으로써 FOXO1이 억제되지 않으면서 정상세포는 손상시키지 않고 유방암에서만 세포사멸을 유발했다.
해당결과는 American Chemical Society 저널에 ‘Small Molecule Targeted Recruitment of a Nuclease to RNA’라는 제목으로 최근 발표됐다.
논문에서 “이번 결과는 저분자화합물와 RNA 분해효소의 결합체가 RNA를 선택적으로 절다하는 편집도구가 될 수 있다는 것을 입증한다”고 밝혔다.
이번 연구를 이끈 Disney 박사는 "거의 모든 질병의 핵심 요인으로 알려진 RNA를 타깃하는 접근방식은 널리 적용될 가능성이 높다. 앞으로 치료법이 알려지지 않은 예후가 나쁜 난치암, 유전질환 등에 초점을 맞춰 연구를 진행할 계획"이라고 성명서를 통해 말했다.


















