국제
CRISPR-버텍스, CRISPR 치료제 임상보류.."업계 술렁"
바이오스펙테이터 김성민 기자
FDA, ex vivo 방식 CIRSPR 기반 겸상적혈구 빈혈 후보물질 'CTX001' 임상1/2상 신청에 '임상보류' 통지..."하반기 예정 유럽임상은 예상대로 진행될 것"
▲CRISPR 테라퓨틱스 홈페이지 자료참조
미국 임상돌입을 앞두고 있는 CRISPR 기반 치료제 후보물질의 임상에 차질이 생기면서 업계가 술렁이고 있다.
CRISPR 테라퓨틱스(Therapeutics)-버텍스(Vertex)는 미국 식품의약국(FDA)으로부터 CTX001의 임상승인신청(IND, Investigational New Drug Application)에 대한 임상보류(clinical hold)를 통지받았다고 지난 31일 밝혔다. CRISPR 테라퓨틱스는 지난 4월 겸상적혈구 빈혈(sickle cell disease) 환자를 대상으로 임상1/2상에 대한 IND를 제출한 바 있다.
이 소식이 발표되면서 CRISPR 테라푸틱스의 주가는 발표후 1시간 만에 14%가 떨어졌다. 미국내 CRISPR/Cas9을 기반으로 치료제를 개발하는 Intellia Therapeutics, Editas Medicine의 주가에도 영향을 미쳤다.
CRISPR 테라퓨틱스-버텍스는 "FDA로부터 가까운 시일내에 추가적인 정보를 받을 것으로 예상하며, 가까운 시일내에 신속하게 문제를 해결하겠다"고 밝혔다.
CPISPR 테라퓨틱스는 "이번 FDA의 임상보류 결정은 수혈의존성 베타-지중해빈혈(TDT, transfusion-dependent β-Thalassemia) 환자를 대상으로 다음 분기에 시작하는 유럽 임상1/2상에 영향을 미치지 않을 것"이라는 입장을 표명했다. CRISPR 테라퓨틱스의 예상대로 하반기에 임상1/2상이 돌입하게 되면 유럽에서 최초로 시작하는 ex-vivo 방식의 크리스퍼 임상이라는데 의의가 있다.
CRISPR 테라퓨틱스와 버텍스는 2015년부터 CRISPR/Cas9 기술을 이용해 유전질환의 유전적 결함을 고치는 치료제 개발에 대한 연구개발 파트너십을 체결했다. 계약에 따르면 버텍스는 최대 6개의 치료제의 라이선스에 대한 배타적인 권리(exclusive right)를 확보하고 있으며 CTX001이 협력의 첫번째 결실이다. CTX001의 경우 양사가 연구개발비를 투입하며, 상업화에 따른 이윤을 공동분배한다.
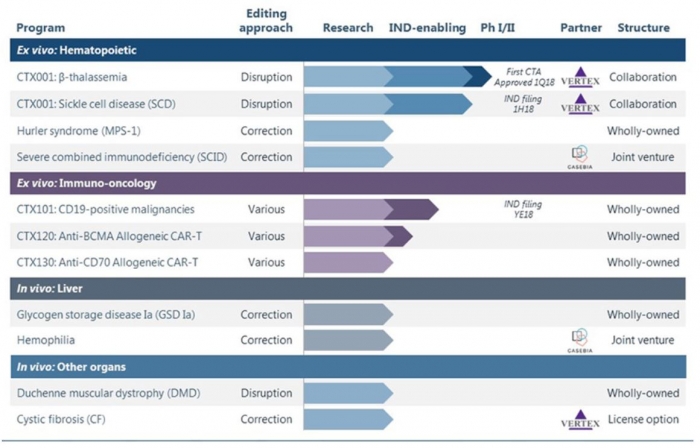
▲CRISPR Therapeutics 파이프라인 현황


















