기업
유한양행 "폐암신약 1/2상 긍정적..내년 3상 진입"
바이오스펙테이터 장종원 기자
ASCO '레이저티닙' 임상데이터 공개..전체 반응률 61%..T790M 변이 환자 반응률 66~86%
유한양행과 제노스코(Genosco)가 3일(현지시간) 미국 임상종양학회(ASCO)에서 공동으로 개발 중인 레이저티닙(Lazertinib 프로젝트명 YH25448,GNS-1480)의 임상 1/2상 임상 데이터를 공개했다. lazertinib은 비소세포폐암 환자에게 나타나는 EGFR 변이 및 T790M 저항성 변이를 타깃으로 하는 경구형 3세대 타이로신 인산화효소 억제제(Tyrosine kinase inhibitor)다. lazertinib은 EGFR T790M 변이의 비소세포폐암 환자에 대한 60%대 이상의 높은 반응률과 낮은 부작용으로 새로운 치료제로서의 가능성을 보였다.
이번에 발표된 결과는 2018년 4월 20일까지 등록된 118명의 중추신경계 전이 여부와 관계없이 EGFR-TKIs에 대한 저항성을 가지는 비소세포폐암 환자를 대상으로 Open-label, 다기관 용량 증량, 용량 확대 형태로 진행한 것이다. 38명이 용량 증량 코호트에, 80명은 용량 확대 코호트에 참여했다.
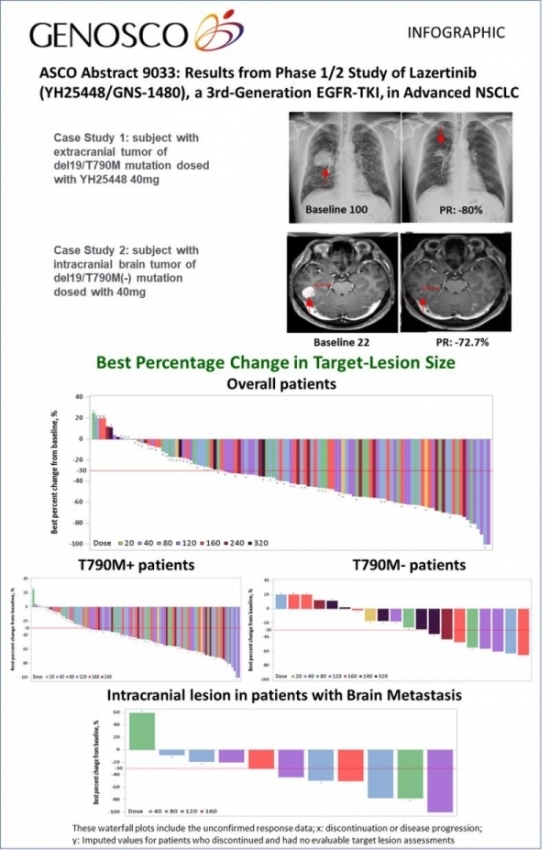
용량 증량 코호트에서는 20~320mg까지 7개 군으로 나눠 각각 하루 한번 정해진 용량을 적용했고 용량 확대의 경우 21일 주기로 매일 20~240mg을 경구투여로 적용했으며 약물의 안전성, 내약성, 약동학적 특징 및 효능을 평가했다.
그 결과 Lazertinib은 최대 320mg을 적용해도 용량 제한 독성이 발생하지 않았다. 또한 약물 부작용과 용량 증량간의 상관관계가 관찰되지 않았다. 약동학적인 분석 결과, 복용 이후 약물이 혈중 최대 농도까지 도달하는 시간은 2시간이었으며 240mg을 적용했을 때 반감기는 64.7시간에 달했다.
데이터 컷오프 기간까지 반응을 확인한 110명의 환자에게서 높은 효과를 보였으며 모든 용량에서 61%의 전체 반응률(Objective response rate; ORR)을 나타냈다. T790M 변이가 발생한 환자(n=92)의 ORR은 66%였으며, 그 중 Lazertinib을 240mg 적용한 그룹(n=7)에서는 86%의 반응률을 나타냈다. 뇌전이가 발생한 환자(n=11)의 반응률은 55%였다. 가장 긴 반응기간은 9.7개월이었으며 아직 반응기간과 무진행 생존기간(Progression-free survival; PFS)에 관련한 중간값은 계산되지 않았다.
약물투여에 따른 부작용으로는 소양감, 식욕감퇴, 가려움증, 변비, 설사 등이 나타났으며 폐와 관련한 부작용은 발생하지 않았다. 또한 3등급 이상의 부작용은 2%에 불과했다.
이번 연구의 책임자인 조병철 연세대 종양학과 교수는 "임상을 통해 얻은 데이터는 인상적이며 Lazertinib이 뇌전이가 발생한 EGFR T790M 변이의 비소세포폐암 환자에게 적용할 수 있는 3세대 TKIs 가운데 Best-in-class 약물이 될 가능성을 충분히 확인할 수 있다. 가장 중요한 것은 용량 증량에 따른 독성 부작용이 발생하지 않으면서 뛰어난 내약성을 보였다는 것"이라고 설명했다. 그는 "현재 3세대 TKIs로 판매중인 타그리소(osimertinib)의 임상1/2상과 비교해 매우 바람직한 결과를 얻었다"고 덧붙였다.
제노스코의 고종성 대표는 "이번 lazertinib의 효능과 안전성 데이터는 치료 옵션이 제한된 환자들을 위한 3세대 EGFR-TKI로서의 가능성을 높여준다"면서 "유한양행과 제노스코는 비소세포폐암 환자를 대상으로 Lazertinib의 글로벌 임상 2상을 시작했으며, 2019년 3상을 진행할 계획"이라고 밝혔다.
송호준 제노스코 이사는 "뇌전이 in vivo 모델과 단일(del19, L858R), 이중(L858R/T790M) 돌연변이 이종 이식 모델에서 Lazertinib과 osimertinib을 비교 분석했을때, 더 뛰어난 선택성과 효능을 보였고 이를 AACR에서 발표했었다. 이번 임상 결과는 전임상 결과가 인간에게 적용될 수 있다는 믿음을 확인시켜 준 것"이라고 전했다.


















