오피니언
AD 치료 '면역'으로 접근...뇌 면역관문분자 "TREM2"
바이오스펙테이터 김성민 기자
[실패 거듭하는 CNS 신약개발⑧]선천성 면역인자 TREM2 변이 알츠하이머병 발병률 높여...독성 단백질 제거하는 DAM 분화 핵심적인 인자 TREM2 ..."알렉토, 디날리 등 TREM2 타깃 신약개발 도전"
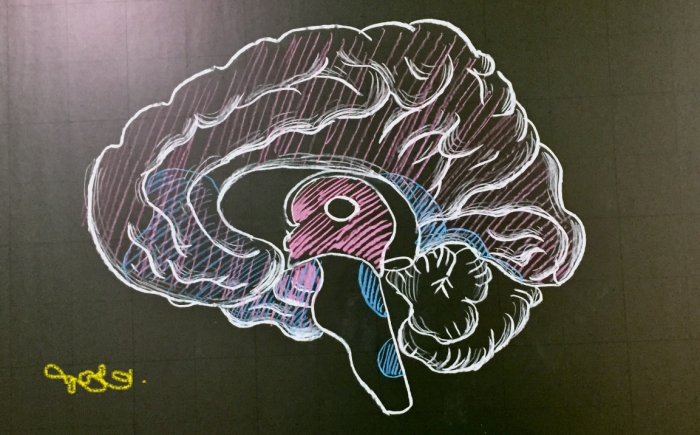
뇌 면역시스템을 이용한 알츠하이머병 치료제 개발이 시도되고 있다. 알츠하이머병에 걸린 뇌는 아밀로이드 플라크가 먼저 쌓이고, 인산화 타우가 축적된다. 이차적인 결과로 신경퇴행이 일어나고 인지감소 등 병리증상이 나타난다. 지난 20년 전부터 환자 뇌에서 아밀로이드와 타우를 제거해 알츠하이머병을 근본적으로 고치려는 노력이 계속됐지만 성공적인 결과를 도출하지 못하고 번번이 실패했다. 최근 에자이-바이오젠은 아밀로이드 항체 'BAN2401'의 긍정적인 임상2b상 결과를 발표하면서 불씨가 되살아나긴 했다.
이같은 상황에서 기업과 연구자들이 뇌 면역시스템을 이용한 알츠하이머병 치료전략에 주목하는 이유는 크게 4가지로 정리할 수 있겠다. 첫째, 아밀로이드 혹은 타우 등 하나의 타깃만 제거해서는 완전한 치료가 어렵다는 의견이 설득력을 얻고 있다는 점. 환자의 뇌에는 여러 종류의 병리 단백질이 혼재한다. 아밀로이드, 타우 외에도 25% 알츠하이머병 환자 뇌에는 TDP-43가 있으며, 알파시누클레인 등도 있다. 둘째, 환자의 병기진행 단계에 따라 겨냥해야 되는 치료타깃이 다르다. 에자이는 preclinical~prodromal 환자에서는 아밀로이드를, 그 이후 단계에서는 아밀로이드와 타우를 같이 공략하는 전략을 세웠다. 셋째, 현재까지 알츠하이머병 신약 연구는 가족성(familial) 알츠하이머병 환자의 병리기전에 포커스했다. APP, PSEN1 유전자 변이를 가진 모델에서 아밀로이드로 유발되는 병리기전에 대한 연구가 중점을 이뤘다. 그러나 전체 환자군의 99%를 차지하는 것은 산발성(sporadic) 알츠하이머병이다. 이들 환자에서 일어나는 신경염증 등 병리기전에 대한 연구는 상대적으로 소홀했다.
마지막으로 약물이 혈뇌장벽(BBB)을 통과해 충분한 치료효과를 보이는 약물 농도에 도달할 수 있는가의 이슈도 있다. 뇌에 축적된 병리단백질을 제거하기 위해 저분자화합물에서 항체로 모달리티(modality)가 옮겨가고 있는 상황에서, 0.1~0.3%의 낮은 BBB 투과성을 가지는 항체가 적절한가에 대한 의문이 제기되고 있다. 이러한 문제를 해결하기 위해 바이오마커 기반으로 약물을 투여하는 전략이 나오고 있고, 또 항체약물의 투과성을 높이는 기술이나 유전자치료제 등 새로운 모달리티도 출현하고 있다.
더 나아가 보편적인(universal) 접근이 필요하다는 고민도 제기됐다. 즉 체내에 ‘이미 있는 방어시스템’을 이용하자는 구상이다. 체내 면역시스템을 일깨워 암을 공격하는 면역항암제(immuno-oncology)가 좋은 예다. 면역세포는 비자기(non-self)를 공격하기 때문에, 기존 타깃치료제의 치료효능을 제한하는 종양 이질성(heterogenecitiy)과 약물 내성문제를 동시에 해결할 수 있다. 면역세포를 '잘' 이용한다면 여러 타깃을 반복해 겨냥하는 효율적인 방법이 될 수 있다.... <계속>
















