국제
상가모, 'in-vivo 유전자교정' 임상발표.."개념증명 입증 부족"
바이오스펙테이터 이은아 기자
헌터증후군 MPSII 대상 'SB-913' 임상 초기결과 발표.."GAG 수치 감소했으나, 혈중 IDS 검출 못해"
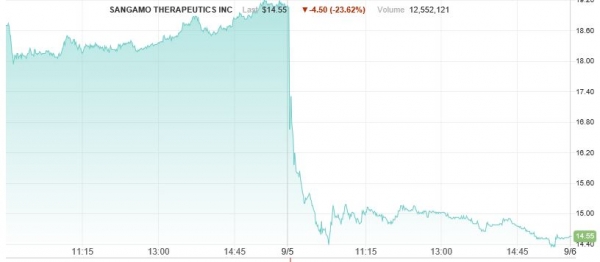
▲상가모 테라퓨틱스가 5일 ZFN 기반 유전자교정 치료제 'SB-913' 초기 임상결과를 발표하자 당일 주식이 23.6% 하락했다.
상가모 테라퓨틱스(Sangamo Therapeutics)의 유전자교정 치료제인 ‘SB-913' 임상결과가 다소 실망스럽게 나와 업계가 떠들썩하다. 헌터증후군이라 불리는 MPSII 질환 대상 임상에서 질환병리학 바이오마커인 GAG는 감소했지만 체내에 넣어준 IDS 유전자의 혈중 단백질은 검출하지 못했다. SB-913의 유전자교정 치료법을 개념증명하기에는 부족한 데이터였다. 5일 상가모가 임상결과를 발표하자 주식은 하루만에 23.6% 하락했다.
MPSII(mucopolysaccharoidosis Type II)은 당단백질(뮤코다당류) 분해에 필요한 iduronate-2-sulfatase(IDS)의 돌연변이로 IDS 효소가 결핍돼 세포 내 리소좀에 독성 탄수화물이 축적되면서 발생하는 희귀대사질환이다. 심각한 경우 발달지체, 장기부전, 뇌손상, 조기사망 등을 초래한다.
2017년 시작한 이번 임상1/2상 연구(CHAMPIONS)는 1세대 유전자가위 징그핑거뉴클레아제(Zinc finger nuclease, ZFN) 기술을 이용한 최초의 임상시험이자, 세계최초로 환자 체내에 유전자가위 도구를 주입하는 in vivo 유전자교정 치료법으로 많은 주목을 받았다.
CHAMPIONS 연구에서 SB-913을 저용량(5x10^12vg/kg), 중용량(1x10^13vg/kg), 고용량(5x10^13vg/kg) 3개의 코호트로 36개월 동안 평가된다. 단 임상에 참여하는 모든 환자는 MPSII의 현재 표준치료법이라 할 수 있는 효소대체요법(enzyme replacement therapy, ERT)을 매주 투여받는다.
SB-913은 ZFN 기술로 AAV6 벡터를 통해 간세포 DNA의 정확한 위치에 새로운 IDS 유전자 사본을 영구적으로 삽입하도록 설계됐다. ZFN가 간세포 DNA에 있는 알부민 프로모터 근처의 특정 부분을 인지, 결합, 절단해 정확한 위치에 IDS 유전자를 통합하는 것이다. 회사 측은 새로 삽입된 IDS 유전자는 MPSII 환자에 부족한 IDS 효소를 발현시켜 축적된 독성 탄수화물을 제거해 환자가 지속적인 치료효과를 보일 것으로 기대했다.
상가모는 SB-913의 임상결과를 처음으로 ‘Annual Symposium of the Society for the Study of Inborn Errors of Metabolism(SSIEM)’ 학회에서 5일 공개했다. SB-913 저용량 군(2명), 중용량 군(2명)에서 안전성 및 효능을 평가한 초기 데이터다.
핵심적인 결과로 MPSII 질병병리학의 주요 바이오마커인 글리코사미노글리칸(Glycosaminoglycans, GAG) 수치가 51% 감소했다. 황산테르마탄(dermatan sulfate), 황산헤파란(heparan sulfate) 수치는 각각 32%, 61% 줄었다. SB-913을 중용량 투여한 환자(코호트2)는 16주차에서 나타난 결과다. 저용량 군에서는 황산헤파란이 23.5% 감소했고 황산테르마탄은 4.1% 증가해 총 GAG 값이 8.9% 증가한 것으로 나타났다.
실망스러은 결과는 낮은 혈중 IDS 수치다. 상가모는 “SB-913 투여 후 기준선에서 16주째 혈장 IDS 활성을 측정한 결과, 현재 분석법의 정량화 수준 이하”라고 밝혔다. 혈중 IDS 값은 SB-913이 간세포에서 IDS 유전자교정에 성공했다는 개념증명을 제공하기 위한 분명한 증거기 때문에 업계가 기대했던 결과였다. 즉, IDS가 분해하는 GAG는 감소했지만, 직접적으로 혈장 IDS 활성을 검출하지 못해 ZFN 기반 유전자교정 치료법의 개념증명을 입증하는데는 부족했다.
그러나 상가모 측은 IDS가 생산되지 않는다는 것을 의미하지 않는다는 입장이다. 노스캐롤라이나(UNC) 의과대학의 Joseph Muenzer 박사는 성명서를 통해 “MPSII 환자는 IDS 효소가 정맥 내로 주입되자마자 세포에 의해 빠르게 흡수돼 저장된 GAG를 파괴한다”며 “매우 적은 양의 IDS가 순환계에 계속적으로 분비되어도 GAG를 분해하기에 충분하다”고 지적했다.
학회에서 Sandy Macrae 상가모 대표는 “IDS가 생산되지 않는 게 아니다. 우리는 낮은 IDS 수치를 검출하기 위해 보다 민감한 분석법을 사용할 계획”이라고 밝혔다.
상가모는 안전성 데이터도 발표했다. 2018년 7월 10일까지 수집된 데이터에서 모든 환자에서 약물 내구성이 우수했으며, SB-913과 관련된 심각한 부작용(SAEs)는 없었다고 발표했다. 대부분의 이상반응(AE)는 1등급이었고 치료없이 해결됐다. 또 2가지 SAE가 보고됐지만 현장 조사관에 의해 MPSII 질환 및 SB-913 치료와 관련없는 것으로 판명됐다고 밝혔다.
최근 상가모는 코호트3(고용량) 환자 투여를 시작했다. 고용량은 저용량보다 5배 많다. Edward Conner 상가모 테라퓨틱스 CMO는 “우리는 현재까지 관찰한 안전성 및 내약성 프로파일과 코호트2의 16주차 GAG 감소결과에 힘을 얻고있다. 중간 용량보다 5배 높인 코호트3 결과를 기대하고 있다”며 “장기간 데이터에서 계속해서 긍정적인 값이 나온다면 유전자교정(Genome Editing)은 MPSII 및 단일변이 질환에서 획기적인 의학적 진보를 가져올 잠재력을 가질 것”이라고 말했다.
상가모는 오는 2019년 2월 미국 플로리다에서 열리는 ‘WORLDSymposium’ 미팅에서 CHAMPIONS 연구의 장기간 안전성 및 효능 결과를 발표할 계획이다.













![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)


