기업
테라젠이텍스, J2H바이오텍 '루게릭 신약' 기술이전 계약
바이오스펙테이터 장종원 기자
후보물질 이전, 전임상 및 임상 본격화..내년 임상1상 신청 계획..글로벌 기술이전시 수익분배

테라젠이텍스가 경구용 근위축측삭경화증(루게릭) 치료제 개발에 나선다. 국내 J2H바이오텍과 공동개발하던 신약후보물질의 글로벌 신약 가능성을 보고 판권을 확보, 기술개발 속도를 높이기로 했다.
테라젠이텍스는 13일 J2H바이오텍과 루게릭병 치료제 라디컷주(성분명 에다라본)의 경구형 유도체 후보물질 'TEJ-1704'에 대한 관련 기술과 글로벌 판권 일체를 확보하고 전임상 및 임상 연구를 본격 개시한다고 밝혔다.
테라젠이텍스와 J2H바이오텍은 이날 오전 서울 양재동에 위치한 테라젠이텍스 제약부문 사옥에서 J2H로부터 관련 기술과 글로벌 판권을 이전받는 계약식도 개최했다.
미쓰비시 다나베가 개발한 리디컷주는 초기 루게릭 환자들의 증상 악화를 지연시키는 효과를 인정받아 2017년 미국 식품의약국(FDA)의 승인을 받았다. 이 제품은 정맥 주사를 통한 투약만이 가능해 환자들이 정기적으로 병원을 방문해야 하며 약제의 체내 농도 조절을 위해 휴약기도 필요했다.
테라젠이텍스와 J2H바이오텍은 작년 MOU를 체결하고 리디컷주를 프로드럭(prodrug) 형태의 경구용 치료제를 개발하기 위한 연구를 해왔다.
J2H바이오텍은 실험용 랫(Rat)을 이용한 실험을 통해 에다라본을 정맥으로 투여했을 때와 경구로 투여했을 때, 그리고 Prodrug 형태의 물질을 경구로 투여했을 때의 혈중 농도를 각각 측정, 비교했다. 그 결과, 에다라본을 경구로 투여했을 때 경구 절대흡수율이 5%에 불과했으나 Prodrug 형태의 경우, 동일한 몰비(molar ratio)로 정맥투여한 에다라본의 혈중 농도 대비 80%에 달하는 활성성분의 흡수가 이뤄지는 것을 확인했다.
경구 투여 제제 개발이 성공하면 환자들의 투약에 따른 정신적, 체력적 문제를 해소할 수 있으며 지속적인 치료 효과도 기대할 수 있을 것으로 기대했다.
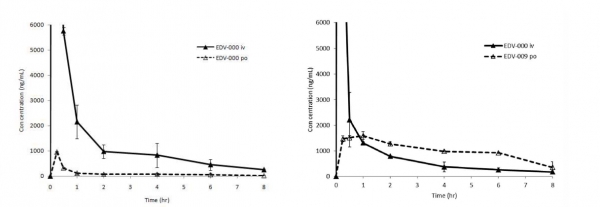
▲에다라본의 정맥투여와 경구투여, J2H-1704(prodrug)의 경구투여 이후 생체 흡수율을 비교한 결과, 동일몰비에서 기존의 정맥투여의 혈중농도 대비 80%의 흡수율을 보였다. J2H 바이오텍 제공.
테라젠이텍스는 이번에 확보한 신약후보물질의 전임상시험을 내년 중 완료하고 곧바로 식품의약품안전처에 임상1상 시험계획 승인을 신청할 계획이다. 회사 측은 라디컷주가 희귀의약품으로 지정된 상태라 5~7년 가량 소요되는 임상시험의 완료 시기가 앞당겨질 수 있을 것으로 전망하고 있다. TEJ-1704가 글로벌 기술이전 되면 테라젠이텍스와 J2H바이오텍이 수익을 나누게된다.
류병환 테라젠이텍스 대표는 "이번 기술이전은 루게릭병에 효과적이면서도 편리한 치료 약물을 개발하는 기반을 마련했다는 점에서 의미가 있다. 앞으로도 신약개발에 연구 역량을 집중해 당사의 미래 성장성을 높일 것"이라고 말했다.
또한 김재선, 유형철 J2H 대표는 "테라젠이텍스와의 협력을 통해 우수한 개발 성과를 거둘 수 있었다"며 "희귀질환 환자들의 미충족 수요에 대한 해결책을 제시하고 이를 실현하기 위해 최대한 노력할 것"이라고 말했다.
이외에도 테라젠이텍스는 인공지능과 빅데이터 분석을 활용해 이 후보물질이 루게릭병 뿐만 아니라 파킨슨병, 치매, 뇌졸중 등 중추신경계 질환 치료제로서의 가능성이 있는지 타진하고 있다.





![[인사]유한양행, 2026년 1월 임원 인사](https://img.etoday.co.kr/crop/74/74/2044634.jpg)

![[인사]일동제약그룹, 임원인사 발령](https://img.etoday.co.kr/crop/74/74/2275874.jpg)




![[인사]유한양행, 2026년 1월 임원 인사](https://img.etoday.co.kr/crop/77/77/2044634.jpg)




