피플
[기고]'PD-1 항체+마이크로바이옴 병용' 개발전략
윤경완 지놈앤컴퍼니 연구소장
면역항암제 글로벌 동향 및 지놈앤컴퍼니 연구개발 전략 소개..마이크로바이옴, 후보균 효능뿐 아니라 MOA 및 안전성 검증 필요
1. 면역항암제 PD-1 글로벌 동향
'제3의 항암제'라 불리는 면역항암제는 지난 10여년동안 기존 항암요법의 패러다임을 완벽히 바꾼 항암제라고 평가되고 있다. 그 이유는 외과적 수술, 화학항암요법, 표적항암요법, 방사능 치료을 포함하는 기존 항암요법은 암세포를 정상세포와 차별적으로 직접 죽이는 항암전략이 기본이나, 면역항암제는 환자의 면역시스템을 이용하여 항암치료를 한다는 측면에서 환자에 따른 항암효능 극대화, 부작용 발생 감소, 암생성 재발률 감소와 같은 장점을 가져왔기 때문이다. 현재 가장 널리 사용되고 있는 면역항암제는 면역체크포인트라고 불리우는 면역조절 세포표면 단백질인 PD-1/PD-L1 혹은 CTLA-4를 저해하는 단일항체 제제다. 생체 내 면역시스템에 의하여 제거 가능한 암세포는 이러한 면역체크포인트 단백질들을 이용하여 종양미세환경이나 면역기관에서의 면역회피 기작을 발전시켜 생존한다. 면역체크포인트 단일항체는 이러한 면역회피 기작을 억제하여 암세포 특이적 면역세포 활성을 통하여 암세포를 죽이는 전략이다. 암 치료에 사용되고 있는 면역체크포인트를 최초 발견하고 암치료에 적용한 공로로 제임스 앨리슨 박사(미국 텍사스대학 MD Anderson 암센터)와 타스쿠 혼조 박사(교토대)가 2018년 노벨생리의학상을 수상했다.
CTLA-4 저해 단일항체 BMS(Bristol-Myers Squibb)의 '여보이(Yervoy, ipilimumab)'는 2011년에 흑색종 환자를 대상으로 최초로 FDA로부터 승인을 받았다. 이어 PD-1 저해 단일항체 MSD의 '키트루다(Keytruda, pembrolizumab)'와 BMS의 '옵디보(Opdivo, nivolumab)'는 2014년 melanoma 환자 대상으로 FDA로부터 승인되어 치료 적용 가능한 암 종을 지속적으로 확장하여 현재 비세포성폐암, 신장암, 요로상피세포암종을 포함하는 10여종 이상의 암 치료에 사용되고 있다. 현재까지의 면역체크포인트 저해 면역항암제 단일치료의 항암 치료 성적은 단연 PD-1 단일항체가 흑색종의 경우 40%, 비소세포성 폐암의 경우 20%으로 가장 우수한 치료효과를 보이고 있다. 그러나 PD-1 단일항체 면역항암제 치료의 대상 환자가 타깃 단백질의 발현 정도에 따라 약 50%만 선정되는 것을 고려하면, 전체 흑색종 환자의 20%, 전체 비소세포성 폐암 환자의 10%만 치료 효능을 보이고 있다.
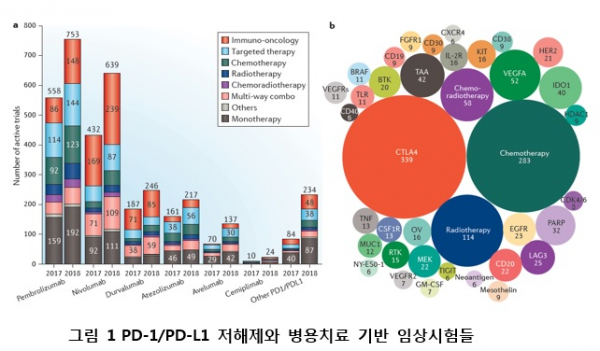
PD-1 항체를 포함한 면역체크포인트 면역항암치료는 매우 효과적인 치료 효과를 보이나, 제한된 환자 집단에서만 치료 효과가 있다는 점 때문에 더 많은 환자에게서 치료효능을 높이고 치료 가능한 암 종을 넓히는 노력이 꾸준히 이루어져왔다. 따라서, 현재 항암치료연구의 가장 하이라이트는 면역체크포인트 치료에 반응이 없는 환자의 원인과 메카니즘을 규명하고 치료 효과을 높이는 치료법 개발이다. 면역항암제의 원인들은 타깃 면역체크포인트의 낮은 발현, 종양미세환경의 면역세포 부재, 종양크기 대비 면역세포 부족, 인터페론 감마 신호전달 불능, TGF-b 신호의 활성화, 다른 면역체크포인트의 발현증가, 장내 마이크로바이옴 구성 등등의 여러가지의 기전으로 설명되고 있다. 이러한 기초연구를 바탕으로 한 면역체크포인트 항암제의 효능을 극대화할 복합치료 전략들이 면역체크포인트 억제 단일항체 약물(PD-1, PD-L1, CTLA-4 항체) 보유 글로벌 제약사들 선두로 하여 폭발적으로 개발되고 있다고 할 수 있다. 현 시점, PD-1 혹은 PD-L1 항체 치료와 복합치료의 임상시험이 1,800여개가 진행되고 있다.
2. PD-1 항체 글로벌 제약사의 개발 동향
현재까지 PD-1 항체 치료와 병용치료법으로 FDA에서 승인한 치료법은 PD-1 항체+ CTLA-4 항체(nivolumab+ipilimumab)와 PD-1 항체+화학항암제(pembrolizumab+chemotherapy)이다. 이 외에도 240개의 각기 다른 항암타깃 치료전략들을 병합하여, 1800여개의 PD-1 항체와의 병용치료 임상시험들이 진행 중이다(그림 1). 이 중 340여개가 CTLA4 항체와의 병용치료로 가장 많고, 280여개의 화학요법과 병용, 120여개의 방사능요법과 병용, 60여개의 화학·방사능요법과 병용, 50여개의 혈관생성억제제와 병용, IDO 혹은 PARP 저해제와 병용 등 신규 타겟기반 치료제들과도 병용 임상시험이 진행되고 있다.
인간에 공생하는 균총 즉 마이크로바이옴이 인간의 생리, 건강과 질병에 밀접히 관련되었다는 것이 최근 연구로 잘 알려지고 있다. 환자의 장내 세균총의 다양성 등 특정유익균, 유해균의 유무에 따라 암생성이나 항암치료 반응률에 영향을 준다는 연구결과가 최근 집중적으로 연구되었다. 특히, 면역항암제 PD-1 항체 치료에 유익한 균총, 혹은 단일균들의 연구를 통하여 PD-1 항체의 효능을 극대화하기 위한 항암 치료전략이 개발되고 있다. 실제로, PD-1/L1이나 CTLA-4 저해제를 보유한 다국적제약사는 각자가 보유한 약물의 효능을 극대화하기 위해, 마이크로바이옴 기반 약물들과의 병용 임상시험에 속속 나서고 있다. MSD는 자사 PD-1 저해제 키트루다(Keytruda, pembrolizumab)와 미국 마이크로바이옴 회사 Evelo의 단일균(EDP1503)의 병용요법으로 여러 암 종의 환자를 대상으로 한 임상 I/II상을 시작하였고, 영국 마이크로바이옴 회사 4D pharma와도 4D Pharma의 생균(MRx0518)과 키트루다의 병용요법으로 고형암 환자들을 대상으로 한 임상시험을 최근 시작하였다. 또한, BMS는 자사 PD-1 저해제 (Opdivo, nivolumab)와 미국 마이크로바이옴 회사 Vedanta의 복합균(VE800)을 병용투여하는 방식의 임상시험계획을 발표한 바 있다.
3. 지놈앤컴퍼니 Immuno-oncology 연구내용
지놈앤컴퍼니는 마이크로바이옴 항암 균주 파이프라인의 의약품 개발을 위하여 현재 미국 임상시험을 준비 중이다. 다음의 5가지 내용을 바탕으로 지놈앤컴퍼니의 항암균주 파이프라인들을 소개하고자 한다. △어떻게 발굴되고 동정된 균주들인가? △후보균들이 얼마나 효능이 좋을 것인가? △후보균들이 효능을 나타내는 메커니즘 (MOA: Mode of action)을 얼마나 명백히 검증하였는가? △인체 적용시 효과를 나타낼 것인가? △의약품으로서의 후보균들의 안전성은 어떠한가? 등이다.
지놈앤컴퍼니는 PD-1 저해제를 포함하는 기존 면역항암제의 항암효과를 높이는 고유의 균들을 면역항암분야 파이프라인으로 보유하고 있다. 지놈앤컴퍼니는 항암효능균들, 항암치료극대화 효능균들을 찾고 동정하기 위하여 대단위의 암환자 vs 정상인 혹은 항암제 반응환자 vs 항암제 비반응환자의 마이크로바이옴을 분석하여 유익균 후보군들을 다수 확보하였다. 이렇게 확보된 유익균 후보군들을 기반으로 지놈앤컴퍼니는 건강한 정상인으로부터 항암균주 동정작업을 시행하여, 다수의 자체균주들를 보유하고 있다.
지놈앤컴퍼니는 자체동정된 균주들의 항암효능, PD-1 면역항암제 치료 극대화 효능을 동물실험을 통한 생체 내 효과를 증명하는 방식으로 동물실험 스크리닝을 진행하였다. 이를 통하여 실제 동물실험에서 가장 PD-1 면역항암제 치료를 극대화하는 균주들을 선정하여 항암균주 파이프라인을 구축하였다. 그 중, 가장 효과적인 균주들은 PD-1의 면역항암제 치료를 극대화할 뿐만 아니라, PD-1 면역항암제 치료에 반응을 보이지 않는 암동물모델에서조차도 PD-1면역항암제 치료 반응을 만들어냄으로써, PD-1 면역항암제 비반응 환자를 대상에 필수적인 병용 균주들임을 증명하였다. 이러한 항암 균주들은 그 단독투여 뿐만 아니라, PD-1 면역항암제 병용투여에서도 장, 면역기관, 혈액 혹은 종양미세환경을 포함하는 생체의 전반적 면역활성도를 변형하여 항암효과나 PD-1 면역항암제의 항암효능을 극대화하는 생체적 토양을 재프로그래밍하였음을 확인하였다.
지놈앤컴퍼니는 항암균주들의 동물실험에서의 효능 확신을 바탕으로 멀티오믹스 기반의 메커니즘 연구를 완료하였다. 항암균주들의 유전체 서열 분석, 전사체 분석, 대사체 분석, 지질체 분석을 통하여 주요 대사물질들을 발굴하였고, 주요 대사물질들이 면역세포 활성화 및 종양내 면역세포 증가에 미치는 효과를 동물실험과 세포실험들을 통하여 증명하였다. 즉, 항암균주들는 특정 대사물질들을 장내로 분비하고 장내에 분포되어 있는 면역세포들의 활성화를 통하여 선천성면역계와 후천성면역계의 순차적 활성체계를 통하여 PD-1 면역항암제의 효능 증폭시키는 메커니즘을 규명하였다.
앞서 동물실험과 세포실험으로 확인한 지놈앤컴퍼니의 항암균주들의 효능은 여러 기증자의 인간 혈액을 통한 세포실험에서도 기존 실험들과 동일한 효과를 확인하였다. 더욱이, 미국 다국적제약사 MSD와 병용 임상시험을 시작한 타 마이크로바이옴 회사의 동일한 종의 균주들과 지놈앤컴퍼니 항암균주들의 비교 효능실험 결과, 지놈앤컴퍼니 항암균주들은 인간세포실험에서 타 마이크로바이옴 회사의 균주 대비 우월한 효능을 보였다. 이러한 실험결과를 바탕으로 지놈앤컴퍼니는 자사의 항암균주들이 PD-1 면역항암제의 병용치료제로서 매우 경쟁력을 갖추고 있는 것으로 자체 평가하고 있으며, 해당 결과들을 검토한 다수 글로벌 제약사로부터 동일한 평가를 받고 있다.
살아있는 균을 이용한 제품들은 요거트와 같은 식품이나 건강기능식품으로 개발되어 소비자와 밀접히 자리잡고 있다. 하지만, 유익균들을 의약품으로 개발하고자 하는 시도는 최근 마이크로바이옴의 인간질병과의 연관성의 이해도 증가와 함께 꾸준히 증가되고 있다고 할 수 있다. 저분자화합물, 항체, 단백질과 같은 기존의 의약품과는 달리, 살아있는 세포 기반의 균주 후보의약품은 기존의 약물 대비 크기도 매우 크고 복잡한 활성과 대사물을 뿜어내는 물질이기 때문에 작용기작을 명백히 하는 것이 매우 중요하고 어려운 부분이라고 할 수 있다. 반면 기존의 약물개발에 있어 독성 관문이 꽤 높은 것과 반대로, 지놈앤컴퍼니가 개발 중인 생균 기반 면역항암제는 건강한 인간 유래, 즉 인간과 공존한 물질 기반이라는 점에서 꽤 안전성이 보장된 물질이라고 할 수 있다. 지놈앤컴퍼니의 항암균주들은 Generally Recognized As Safe(GRAS: 미국 식품의약품법에서 지정한 '일반적으로 안전 하다고 알려진 성분')으로 명시되어 있는 균의 일종으로 인체 안전성이 공식적으로 인정된 균에 속한다. 지놈앤컴퍼니는 이러한 균주 인체 안전성을 바탕으로 암환자를 대상으로 PD-1 면역항암제와 항암균주들의 병용임상시험을 준비 중이며, 2019년 하반기 미국 FDA IND 신청 후 임상시험 돌입을 목표로 하고 있다.
-References
1. Tang J et al., “Trial watch: The clinical trial landscape for PD1/PDL1 immune checkpoint inhibitors”, Nature Reviews Drug Discovery 17(12), November 28, 2018: 854-855.
2. Veillette A et al., “Developing combination immunotherapies against cancer that make sense”, Science Immunology 3(29), November 2, 2018
3. Patel SA et al., “Combination Cancer Therapy with Immune Checkpoint Blockade: Mechanisms and Strategies”, Immunity 48(3). March 20, 2018: 417-433.
4. Sears CL et al., “The intestinal microbiome influences checkpoint blockade”, Nature Medicine 24(3), March 6, 2018: 254-255.
5. Wang Y et al., “Modulation of Gut Microbiota: A Novel Paradigm of Enhancing the Efficacy of Programmed Death-1 and Programmed Death Ligand-1 Blockade Therapy”, Frontier in Immunology 9, March 5, 2018: 374.
6. Jobin C, “Precision medicine using microbiota”, Science 359(6371), January 5, 2018: 32-34.
7. Gopalakrishnan V et al., “Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients”, Science 359(6371), January 5, 2018: 97-103.

















