국제
FDA, 바이오시밀러 '상호교환성' 최종 지침 발표
바이오스펙테이터 봉나은 기자
스위칭임상 등 통해 '상호교환성' 인정받으면 의사 개입없이 '대체조제'까지 허용.."인슐린부터 확산 기대"

미국 식품의약국(FDA)이 오리지널 바이오의약품을 동등한 효능의 바이오시밀러로 교차처방, 대체조제할 수 있는 길을 열었다. 미국에서 바이오시밀러 시장이 확산하는데 중요한 계기가 마련됐다는 평가다.
FDA는 지난 10일(현지시간) 바이오시밀러 상호교환성에 대한 지침(Considerations in Demonstrating Interchangeability With a Reference Product Guidance for Industry)을 발표했다.
이번 지침은 합성의약품 복제약(제네릭)과 마찬가지로 바이오의약품을 처방자의 개입없이 바이오시밀러로 대체조제할 수 있는 ‘상호교환성(Interchangeability)’ 승인에 대한 내용으로 2017년 1월 초안이 나온 이후 2년만에 최종지침이 나왔다. FDA는 2018년 바이오시밀러 활성화 계획(Biosimilar Action Plan)을 내놓는 등 바이오의약품의 경쟁을 촉진하는 정책을 추진해왔는데 이번 지침 역시 이러한 기조가 반영됐다.
FDA는 2015년부터 현재까지 19개의 바이오시밀러를 승인했는데 셀트리온의 인플렉트라(램시마), 트룩시마, 허쥬마, 삼성바이오에피스의 렌플렉시스, 온트루잔트 등이 대표적이다. 하지만 오리지널 의약품과 바이오시밀러의 교차처방, 대체조제는 허용하지 않았고 관련 기준도 없어 신규 환자에게만 사실상 처방돼 왔다. 미국 대부분의 주에서 약제비를 절감하기 위해 상호교환성을 인정받은 바이오시밀러는 대체조제가 가능하도록 관련 법을 개정했는데 이제야 관련 지침이 나왔다.
FDA는 이번 지침에서 상호교환성을 인정받기 위해 필요한 각종 데이터, 스위칭(switching) 임상 진행을 위한 방법 등을 구체적으로 제시했다. 이러한 기준을 충족한 바이오시밀러는 오리지널 의약품을 대체할 수 있도록 승인할 예정이다.
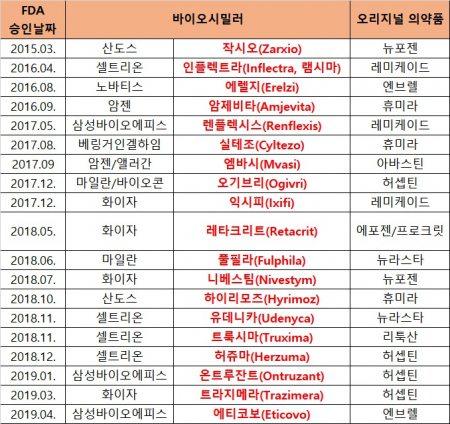
▲FDA가 승인한 바이오시밀러(바이오스펙테이터 재구성)
상호교환성을 입증받기 위해 요구되는 데이터에는 ▲중요한 품질 속성 식별 및 분석 ▲오리지널과 바이오시밀러간의 차이점 및 잠재적 임상영향 분석 ▲각 적응증에 대한 메커니즘 분석 ▲약물동력학(PK) 및 생체 내 분포(biodistribution) 차이 분석 ▲면역원성 위험 차이 분석 ▲적응증, 환자집단에 따른 독성차이 분석 ▲제품의 안전성 또는 효능에 영향을 미칠 수 있는 요소에 대한 정보 등이 포함된다.
지침은 특히 상호교환성을 인정받기 위한 스위칭 임상에 대한 구체적인 내용을 담았다. ‘스위칭 연구 또는 상호교환성을 입증하는데 필요한 연구의 설계 및 분석에 대한 고려사항(Considerations for the design and analysis of a switching study or studies to support a demonstration of interchangeability)’, ‘스위칭 연구에서 비교 제품에 대한 고려사항(Considerations regarding the comparator product in a switching study or studies)’ 등이다.
스위칭 임상은 초안과 마찬가지로 오리지널의약품과 바이오시밀러간에 2회 이상 교체처방했을때 치료 변화를 평가하도록 했다. 예를 들면 ‘오리지널→시밀러→오리지널→시밀러’ 같은 방식으로 최소 3회 이상 전환과정이 필요하다는 것이다. 일반적으로 하는 스위칭 임상 표준인 1회 노출(오리지널→시밀러) 대비 까다로운 기준이다.
다만 초안에 담긴 미국에서 허가받은 약물만 스위칭 임상의 대상이 된다는 기준은 완화해 과학적 근거와 데이터가 있다면 미국에서 허가받지 않은 약물도 비교할 수 있도록 했다. 아울러 스위칭 연구의 1차 평가 변수를 임상 유효성보다는 약물 동태학적(PK)/약력학적(PD) 평가에 두도록 해 바이오시밀러 개발사들의 부담을 덜어줬다. 과학적 타당성이 있다면 환자가 아닌 건강한 사람을 대상으로 스위칭 임상을 할 수 있도록 했다. 아울러 바이오시밀러 개발사가 스위칭 연구 데이터가 필요없다고 판단한다면 FDA에 관련 자료를 제출하고 협의할 수 있도록 길을 열었다.
네드 샤프리스(Ned Sharpless) FDA 임시국장은 “바이오시밀러는 암, 류마티스 관절염, 당뇨병, 다발성 경화증 같은 심각한 질환을 앓고 있는 환자에게 중요한 치료 선택권”이라며, “유럽에서는 2006년부터 다양한 바이오시밀러를 적극적으로 사용하는 가운데, 미국은 2010년에서야 바이오시밀러 승인에 대한 법안이 만들어졌다. 이번 상호교환성 승인에 대한 최종 지침으로 바이오시밀러 개발사들에게 기준을 명확히 제시할 수 있을 것”이라고 말했다.
FDA는 이번 지침으로 당뇨병 치료제인 인슐린의 대체조제가 활발히 진행되기를 기대했다. 인슐린은 평생 사용해야 하는 제품임에도 대체조제가 허용되지 않아 환자나 보험당국의 부담이 컸다. 샤프리스 임시국장은 “인슐린 바이오시밀러 대체조제에 대한 이해관계자들의 이야기를 들을 예정"이라면서 "최종 지침이 상호교환 가능한 인슐린 제품의 시장 진출도 가능케 할 것"이라고 말했다.














![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)



