국제
美벨리쿰, 고형암 표적 CAR-T 1/2상 중간결과 발표
바이오스펙테이터 시카고(미국)=봉나은 기자
[2019 ASCO]'PSCA 발현' 전이성 췌장암 환자 18명 대상 GoCAR-T ‘BPX-601’ 1/2상 중간결과 발표..보조약물 '리미듀시드' 투여 환자서 최대 150일 더 생존하는 체내 T 세포 활성 확인
미국 벨리쿰 파마슈티컬스(Bellicum Pharmaceuticals)가 고형암 타깃 CAR-T의 가능성을 확인한 ‘BPX-601’의 임상 1/2상 중간 결과를 공개했다. 현재 전세계적으로 혈액암 대상의 항 CD19 CAR-T 치료제 분야가 활발한 가운데 벨리쿰은 고형암 공략을 위해 PSCA를 타깃함은 물론 CAR-T 세포의 생존 및 활성을 조절할 수 있는 보조 약물을 활용하는 전략으로 주목받고 있다.
벨리쿰 파마슈티컬스는 1일(현지시간) 미국 시카고에서 열린 ‘2019 미국임상종양학회(ASCO)’에서 고형암 환자를 대상으로 개발 중인 항 PSCA CAR-T 후보물질 ‘BPX-601’의 임상 결과를 발표했다.
▲지난 1일(현지시간), 벨리쿰 파마슈티컬스의 포스터 발표 현장
세포 표면의 단백질인 전립선 줄기세포 항원(Prostate stem cell antigen, PSCA)은 전립선 상피조직, 방광, 신장, 식도, 위, 태반 등 체내 조직에서 많이 발현되며, 췌장암을 포함한 다양한 고형암에서 높게 발현돼 주목받고 있는 치료 타깃이다. 병의 진행단계와도 관련돼 있다고 알려졌다. 이중 췌장암 환자에게 적용된 BPX-601은 PSCA-CD3ζ CAR를 발현하는 자가 T 세포 치료제로, 벨리쿰의 GoCAR-T 플랫폼을 적용한 첫 후보물질이다. 벨리쿰은 GoCAR-T 세포가 '암세포 항원'과 보조약물 ‘리미듀시드(Rimiducid)’에 모두 노출됐을때 완전히 활성화될 수 있다고 소개했다. 리미듀시드 투여에 따라 CAR-T 세포의 활성화 정도를 조절할 수 있는 것이다. CD19 수용체를 타깃하는 CAR-T 세포는 몇몇 환자에서 10만배 이상 증식하는 반면, 며칠 또는 몇 주안에 세포의 증식과 지속성을 유지하는데 실패하는 것으로 알려져 이를 보완할 수 있는 방법으로 고안됐다.
벨리쿰이 이번 2019 ASCO에서 포스터를 통해 발표한 내용은 PSCA를 발현하는 전이성 췌장암 환자를 대상으로 한 BP-012 임상 1/2상(NCT02744287)의 중간 결과다. BP-012 임상은 ‘BPX-601’과 CAR-T 세포의 활성을 돕기위한 보조 약물 '리미듀시드'를 투여하는 치료 요법의 안전성, 생물학적 및 임상적 활성을 평가하기 위해 2개 임상으로 설계됐다. 현재 3+3 세포 용량 증량 임상 1상이 진행 중이다.
벨리쿰은 포스터를 통해 BPX-601을 투여받은 환자 18명의 결과를 지난 4월 23일까지 분석한 내용을 공개했다. 일반적으로 CAR-T 치료제를 투여받기 전 림프구 제거 요법으로 플루다라빈(Flu)이나 사이클로포스파마이드(Cy)를 처방한다. 벨리쿰은 BPX-601을 투여받은 초기 13명의 환자에게 림프구 제거 요법으로 Cy를 투여하고, 이후 최근 코호트에 등록된 5명의 환자에게는 Flu/Cy를 투여했다. 이후 환자들은 3개 용량(1.25, 2.5, 5.0x10^6 cell/kg)군으로 나뉘어 각각 BPX-601를 투여받았다. 이중 4명의 환자에게는 리미듀시드를 투여하지 않았으며, 나머지 14명의 환자에게는 BPX-601 투여 후 약 1주일차에 리미듀시드를 투여했다.
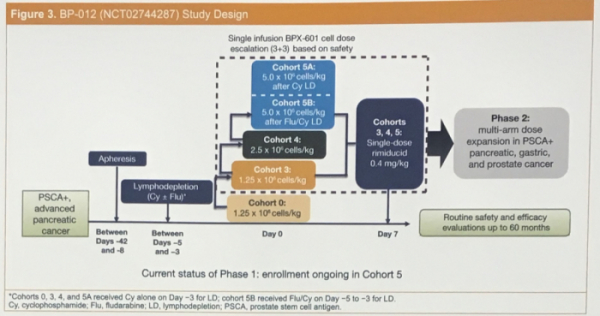
▲BP-012 임상 디자인(출처: 벨리쿰 파마슈티컬스 2019 ASCO 발표 포스터)
BPX-601을 투여받은 환자 18명은 1단계 이상의 이상 반응을 경험했다. 이는 세포독성 화학항암치료나 다른 면역항암치료를 받은 환자에게서 나타나는 결과와 유사하다. 가장 빈번하게 나타난 이상반응은 발열성 호중구 감소증(33%), 피로(28%), 백혈구 감소증(28%), 발열(28%), 배뇨통(22%), 혈뇨(22%), 구토(22%)였다. 데이터 분석일까지 용량 제한 독성(DLT)은 확인되지 않았다.
리미듀시드를 투여받은 환자 중 4명에게는 2단계의 사이토카인 방출 증후군(CRS)이 나타나기도 했지만 Tocilizumab을 투여받은 당일, 증상이 나아졌다. 또한 리미듀시드를 투여받지 않은 환자와 달리, 리미듀시드를 투여받은 환자의 체내 BPX-601 CAR-T 세포가 적게는 10일에서 최대 150일까지 더 오래 생존하는 것을 확인했다. 이에 벨리쿰은 BPX-601 투여 후 7일 간격으로 리미듀시드를 처방해 CAR-T 치료제의 기능을 지속적으로 재활성화시키는 연구도 시도해볼 계획이라고 밝혔다.
BPX-601과 리미듀시드를 1회 투여하고 치료 효능을 평가한 13명 중 3명의 종양 크기는 10~24% 감소했으며, 이들을 포함한 총 8명(62%)에게서는 종양이 더 이상 진행되지 않은 안정 병변(SD)이 관찰되기도 했다.
한편, 벨리쿰은 지난해 12월 스위스 제네바에서 열린 유럽종양학회-면역항암제(ESMO-IO)에서 BP-012 임상 1/2상의 중간 결과를 처음 공개했다. 지난 1월 미국 샌프란시스코에서 열린 2019 위장관 종양 심포지엄(GCS)에서 BPX-601의 안전성 프로파일을 공개한 바 있다. 벨리쿰은 당시 임상 결과를 통해 몇몇 환자에게서 리미듀시드 투여로 CAR-T 세포의 증식과 지속성을 촉진시키고, 임상적 이점이나 질병 통제에 대한 초기 근거가 될 수 있음을 확인했다고 밝혔다.
▲BP-012 임상을 이끈 Carlos Roberto Becerra 베일러 의과대학 교수














![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)




