국제
獨 큐어백의 mRNA 차세대 백신개발 플랫폼은?
바이오스펙테이터 조정민 기자
리디아 오스트포겔스 상무, 2019 GBC 백신포럼에서 플랫폼 기술 소개.. “광견병 등 감염질환, 항암면역백신, 희귀질환 파이프라인 보유”

▲CureVac의 2019 GBC 백신포럼 발표현장.
“큐어백은 자연적인 인체 내 원리와 같은 기능적 원리를 기반으로 작동하는 mRNA기반 차세대 백신을 개발하고 있으며 이는 질병을 예방하는 백신뿐 아니라 치료백신, 항암백신, 희귀질환의 분자치료 등 다양한 분야에 적용이 가능하다.”
독일 백신개발기업인 큐어백(CureVac)의 리디아 오스트포겔스(Lidia Oostvogels) 상무(VP)는 지난달 27일 서울 삼성동 그랜드 인터컨티넨탈 서울 파르나스에서 개최된 ‘2019 글로벌 바이오 컨퍼런스(2019 GBC)’의 백신포럼에 참석해 본인들의 플랫폼 기술과 파이프라인을 소개했다.
2000년 설립된 큐어백은 RNA를 통해 질병 치료 및 예방 면역을 형성하는 백신과 치료제를 개발하고 있다. 이들은 화학적 변형된 것이 아닌 천연의 mRNA를 사용하는 것이 특징으로 사노피, 베링거인겔하임, 일라이 릴리 등과 공동연구를 진행하고 있다.
◇ ‘유전자→단백질’ 과정서 중요한 정보 전달자 mRNA 최적화 플랫폼 확보
생물의 유전정보를 전달되기 위해서는 일련의 과정을 거치는데 이를 ‘센트럴 도그마(central dogma)’라고 한다. 핵 안에 존재하는 DNA는 전달하고자 하는 유전정보를 mRNA(messenger RNA)로 만든다. 핵에서 세포질로 빠져나간 mRNA는 단백질로 번역되며, 단백질이 실질적인 기능을 하게 된다.
mRNA는 4개의 뉴클레오타이드가 선형으로 이어진 폴리머(polymer)형태이며 Cap(손상으로부터 보호하는 부분), UTR(번역되지 않는 부분), 실제로 단백질을 만드는데 사용되는 유전정보를 포함한 CDS(coding sequence) 등으로 이뤄져 있다.
큐어백은 RNA를 최적화하는 플랫폼 기술들을 통해 가장 타깃에 적합한 mRNA를 생산할 수 있다는 설명이다. 이렇게 생산한 mRNA를 활용해서 치료제 및 백신을 개발하고 있으며 타깃하는 분야는 감염병, 항암, 분자치료 등이다. 감염병과 종양의 경우 예방 및 치료 백신, 항체치료제 등을 개발하고 있다. 체내에서 특정한 단백질의 생성이 부족해 질병이 발생하는 경우에도 mRNA 기술을 통한 분자 치료가 가능하다.
백신에서 체내의 면역체계를 활성화시키는 역할을 수행하는 항원은 매우 중요한 요소 중 하나다. 백신의 효능에 항원 설계는 큰 영향을 미친다. 큐어백은 타깃 특이적인 아미노산 시퀀스 최적화를 통해 높은 면역원성을 가진 단백질을 생성하도록 고안된 mRNA 기술 ‘RNAntigen’을 통해 치료 효능을 향상시켰다. 회사 측은 실제로 광견병 백신 항원 제작에 RNAntigen 기술을 적용한 결과, 항원 발현 정도가 최대 7배까지 차이났으며 항체 유도 능력 역시 약 3배 증가한 것을 확인했다고 설명했다.
큐어백은 mRNA 시퀀스의 구성요소 중 번역되지 않는 부위인 UTR 역시 항원 발현에 있어서 중요하다는 것을 확인했다. 이들은 동일한 CDS에 각기 다른 UTR 염기서열을 적용해 항원 발현을 확인했는데 UTR에 따라서 항원 발현이 최대 3배까지 차이가 나는 결과를 얻었다. 큐어백은 UTR이 mRNA 배열과 안전성, 이동 및 번역 효율성에 영향을 미친다고 밝혔다.
큐어백은 RNAntigen 기술을 기초로 기능성 항체 및 유사 단백질 장기(long-term) 발현을 유도하는 ‘RNAntibody’, 전염병이나 암 등에서 강력한 면역 요법을 제공하는 백신 개발하는 ‘RNActive’, 선천성 면역체계를 활성화하는 아쥬반트 기술인 ‘RNAdjuvant’ 등을 개발, 확보하고 있다.
또한 RNA 분해효소 등에 의해서 체내 불안정성이 강하고 세포 내 투과가 어려운 mRNA를 안정적으로 세포 내로 침투할 수 있도록 하기 위해서 Acuitas therapeutics가 개발한 지질성분의 나노입자를 mRNA 전달체로 활용했다.
회사 관계자는 “mRNA만을 투여해서 국제보건기구(WHO)가 설정한 최소한의 효과를 확인하려면 mRNA를 40μg을 적용해야 하는데 나노입자를 적용한 mRNA 백신의 경우 0.05μg만 적용해도 같은 면역 활성화를 보였고 5μg을 적용했을 떄에는 1000배의 효과를 나타냈다”며 “나노입자를 통한 RNA전달이 치료 효과를 높이는데 중요한 요소인 것을 확인했다”고 말했다.
◇광견병 백신 임상1상 진입.. ‘항암백신+PD-1 항체’ 임상1상도 진행 중
큐어백의 RNA 백신 작용기전은 다음과 같다. 지질성분의 나노입자를 적용한 큐어백의 백신을 인체에 근육주사 형태로 주입하면 단핵구, 수지상세포, 대식세포 등 면역세포가 나노입자를 흡수한다. 세포 내로 들어간 나노입자에서 분리된 mRNA는 세포 내에 존재하는 리보솜에 의해 단백질 형태의 항원으로 합성된다. 합성된 항원은 항원제시세포 표면의 MHC I 수용체에 전시되고 이를 통해 CD8+ T세포와 CD4+ T세포, B세포 등 면역체계가 활성화되는 것이다.
큐어백은 현재 예방백신으로 광견병, 인플루엔자, 말라리아 등의 파이프라인을 개발하고 있으며 광견병 백신의 경우 전임상을 마치고 임상 1상을 진행하고 있다. 회사 측은 “광견병 백신의 경우 상업적으로 출시된 제품이 존재하지만 효과가 충분하지 않아 아직까지 미충족 수요가 존재한다”며 개발 이유를 밝혔다.
큐어백은 GBC 행사 강연에서 광견병 백신 ‘CV7201’의 전임상 결과에 대해 발표하기도 했다. 이들은 광견병 바이러스에 감염된 쥐에게 완충액(buffer)를 적용한 대조군의 경우 10일뒤 모든 개체가 사망했지만, CV7201을 두개내 주사(intracranial injection)로 적용했을 때에는 100% 생존율을 확인했다. 또한 기존의 광견병 백신으로 사용되는 인간 이배체 세포 백신(Human diploid cell vaccine; HDCV)의 경우 적용 이후 약 10%의 체중감량이 관찰된 반면, CV7201 적용군에서는 체중감량이 관찰되지 않았다.
큐어백은 원숭이를 이용해 영장류를 대상으로 효능을 확인하는 전임상도 진행했다. 이들은 이미 상용화된 광견병 백신인 ‘Rabipur’와 CV7201 10μg, 100μg을 각각 원숭이에게 적용하고 바이러스 중화항체(VNT) 발현 농도를 비교했다. 그 결과 ‘Rabipur’의 경우 3회 투여가 진행됐을 때 발현되는 항체 농도가 큐어백의 mRNA백신의 2회 투여만으로도 발현되는 것을 확인했다. Rabipur의 경우 5회 투여를 원칙으로 적용되고 있다.
큐어백은 CV7201을 튜여한 후 항체 발현 유지기간을 확인하기 위해 1년간 관찰을 진행했을 때, 340일이 경과한 이후에도 WHO의 최소 역치보다 15배 이상의 높은 농도로 면역반응이 유지되는 결과를 얻었다.
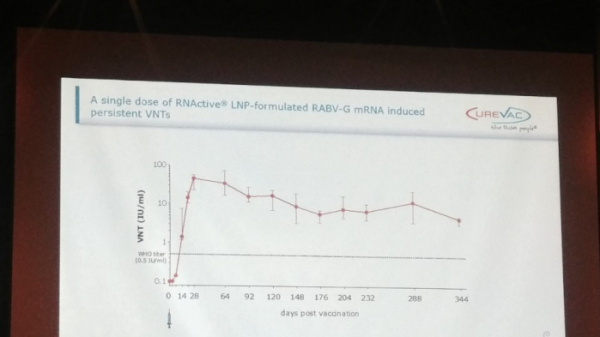
▲(CureVac의 2019 GBC 발표 자료)
큐어백은 이러한 전임상 결과를 바탕으로 인간 대상 임상1상을 진행했다. 100여명의 건강한 성인을 대상으로 진행한 이 임상은 mRNA 기반 예방백신에 대한 안전성과 면역원성을 시험하기 위한 최초의 인체 내 증명 임상이었으며, 그 연구가치를 인정받아 국제 임상 학술지 중 하나인 ‘Lancet’에 게재됐다.
큐어백이 예방백신 외에도 개발에 집중하고 있는 분야는 항암면역백신이다. 이들은 mRNA를 기반으로하는 능동적 면역법 중 하나로 환자의 면역체계를 활성화해 암세포를 공격하도록 한다. 큐어백은 종양특이적 항원 또는 종양 관련 항원에 해당하는 mRNA를 투여함으로써 TLR7에 의해 매개되는 체액성 및 세포성 면역체계를 활성화하는 전략을 구사한다.
큐어백의 항암백신 경쟁력은 이미 항암제를 개발중인 글로벌 제약사들에게 인정받아 베링거잉겔하임, 일라이 릴리 등과 파이프라인 공동개발을 진행하고 있다. 베링거잉겔하임과는 비소세포폐암을 대상으로 면역관문억제제와 큐어백의 백신을 병용투여 효과를 확인하는 임상1상을 진행하고 있으며 릴리와는 면역관문억제제와 병용할 신항원(neoantigen) 타깃 백신에 대한 개발을 진행중이다.

















