기업
셀트리온 램시마SC 확산, '1.5세대 치료제' 전략은
바이오스펙테이터 바르셀로나(스페인)=장종원 기자
[UEGW 2019]바이오베터 내세워 TNF-α 치료제 이탈 환자 흡수..2020년 1분기 직판체제 통해 출시

▲안익성 셀트리온헬스케어 상무.
셀트리온이 차세대 제품으로 공을 들여온 램시마 피하주사제형(SC)의 유럽 시장 확산 전략을 공개했다. 인플릭시맙의 우수한 효과에 안전성, 편의성까지 더한 바이오베터 램시마SC를 기존 1세대 TNF-α계열 치료제의 다음 버전인 1.5세대 치료제로 육성한다는 계획이다. 연내 유럽 집행위원회의 최종 시판 승인이 예상되는 램시마SC는 내년 1분기 셀트리온이 구축한 직판체제를 통해 유럽시장에 출시될 전망이다.
안익성 셀트리온헬스케어 상무는 23일(현지시간) 스페인 바르셀로나에서 열린 UEGW(United European Gastroenterology Week) 학회장에서 기자와 만나 "램시마SC는 기존 바이오시밀러와 경쟁하지 않을 것"이라면서 "램시마SC를 1.5세대 치료제로 육성해 시장에 확산할 계획"이라고 밝혔다.
TNF-α계열 최초 치료제인 인플릭시맙은 오랜 누적 처방 데이터와 우수한 효과에도 불구하고 편의성과 의료비 절감 효과를 내세운 SC제형에 시장을 잠식당해왔다. 이에 따라 인플릭시맙의 약점을 보강한 램시마SC의 등장은 새로운 치료옵션으로 시장에 자리매김할 수 있다는 설명이다.
안 상무는 "치킨게임으로 치닫는 바이오시밀러간의 경쟁에 램시마SC가 뛰어들 생각은 없다"면서 "TNF-α계열 치료에 실패해 고가의 2세대 치료제(얀센의 스텔라라 등)로 옮겨가는 환자군을 램시마SC가 공략할 계획"이라고 말했다. TNF-α계열 환자군 중 효과가 없어 이탈하는 최대 40~50% 환자군에 램시마SC가 의사의 판단하에 전환처방하는 '메디칼 스위칭 치료제'로 활용될 수 있다는 것이다.
그는 이어 "1.5세대 치료제로의 램시마SC는 경쟁자가 없는 독자적인 시장을 확보하게 될 것"이라면서 "메디칼스위칭 치료제로서의 램시마SC의 효능, 2세대 치료제보다 상대적으로 낮은 가격 등을 내세워 유럽 국가와 시장을 설득하는 작업을 시작했다"고 말했다.
셀트리온과 셀트리온헬스케어는 램시마SC 출시계획도 소개했다. 램시마SC는 지난 9월 유럽 의약품청(EMA) 산하 약물사용자문위원회(CHMP)로부터 승인 권고를 획득해 유럽 집행위원회(EC)의 최종 시판 허가를 기다리고 있다. 램시마SC는 직판체제 구축을 선언한 셀트리온의 첫 제품이라는 점에서도 의미가 크다.
안 상무는 "12월말까지 유럽 전역의 직판체제 구축을 완료할 계획"이라면서 "내년 1분기 구축한 직판체제를 통해 램시마SC를 출시할 계획"이라고 설명했다. 그는 이어 "램시마SC의 블록버스터로의 성장, 안정적 직판체제의 구축은 셀트리온이 글로벌 제약사로 성장하는 계기가 될 것"이라고 강조했다.
이어 이상준 셀트리온 임상개발본부 수석부사장은 램시마SC의 성공을 가속화할 적응증 확장 계획 및 추가 임상 진행 계획을 소개했다. 먼저 셀트리온은 이번 UEGW 학회에서 공개한 램시마SC IBD 주요(Pivotal) 임상 결과를 바탕으로 연내 EMA에 램시마SC의 추가 적응증(IBD 등) 허가를 요청할 계획이다. 내년 상반기내에 적응증 확장을 완료해 판매에 돌입하는 것이 목표다.
이 부사장은 "램시마SC의 장기 안전성 데이터를 확보하기 위한 작업도 시작할 계획"이라면서 "Diret Study, Better Study, Mega Study 등 다양한 램시마SC 연구가 계획되고 있다"고 설명했다.
이 부사장은 "셀트리온은 지금까지 쉬운 길을 간적이 없다. 언제나 새로운 길을 개척하면서 여기까지 왔다"면서 "램시마SC를 통한 새로운 도전에도 최선을 다하겠다"고 강조했다.
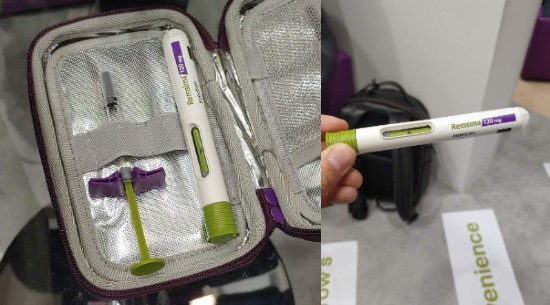
▲셀트리온이 공개한 램시마SC 프린필드시린지, 오토인젝션 제형.














![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)


