국제
아카디아, '치료제없는' 조현병 음성증상 2상서 긍정결과
바이오스펙테이터 서일 기자
환각 및 망상 치료제 '누플라지드' 조현병 적응증 확대 위한 2상서 1차 종결점 충족..2020년 상업화 임상 예정

아직 치료제가 없는 조현병(schizophrenia) 음성증상(negative symptoms)에 대한 긍정적인 임상결과가 나왔다. 아카디아 파마슈티컬스(ACADIA Pharmaceuticals)는 조현병 음성증상 환자를 대상으로 한 피마반세린(Pimavanserin) 임상 2상(ADVANCE study, NCT02970305)에서 1차 종결점을 충족하는 탑라인(top-line) 결과를 지난 27일(현지시간) 발표했다.
피마반세린은 5-HT2A, 2C 수용체를 억제하는 세로토닌 길항제(antagonist)로 지난 2016년 미국 식품의약국(FDA)에서 '누플라지드(NUPLAZID®)'란 상품명으로 파킨슨병과 관련된 환각 (hallucinations), 망상(delusions)에 대한 치료제로 승인됐다. 아카디아의 분기 보고서에 따르면 2019년 3분기 9460만달러 매출을 냈다.
현재 사용되고 있는 조현병 치료제는 클로자핀(Clozapine), 지프라시돈(Ziprasidone)과 같은 항-정신성 약물로 도파민과 세로토닌 등 뇌 호르몬을 조절하는 양성증상 치료제다. 아직까지 FDA에서 승인된 조현병 음성증상 치료제는 없다
ADVANCE 임상은 403명의 기존 항-정신병 치료제로 양성증상(positive symptoms)을 조절해온 조현병 환자중 음성증상을 보이는 환자를 대상으로 진행했다. 피마반세린은 10, 20, 34mg의 3개 농도로 진행해 효과와 안정성을 플라시보(placebo) 대조군과 비교 평가했다.
ADVANCE 임상에서 피마반세린은 1차 종결점인 16개 지표로 구성된 NSA-16(Negative Symptom Assessment-16) 분석에서 음성증상을 통계적으로 유의미하게 개선했다(피마반세린-10.4, 대조군 -8.5, p=0.043; effect size=0.21). 고농도인 피마반세린 34mg을 처방받은 환자군(107명)에서는 더 효과적으로 증상이 개선됐다(피마반세린34mg-11.6, 대조군-8.5, unadjusted p=0.0065, effect size=0.34). 2차 종결점인 개인,사회적 성과지표(Personal and Social Performance(PSP) scale)는 개선되지 않았다.
ADVANCE 임상 추가 데이터는 추후 학회에서 발표 예정이다. 아카디아는 2020년 상반기에 피마반세린의 상업화 임상(Pivotal study)을 시작할 계획이다.
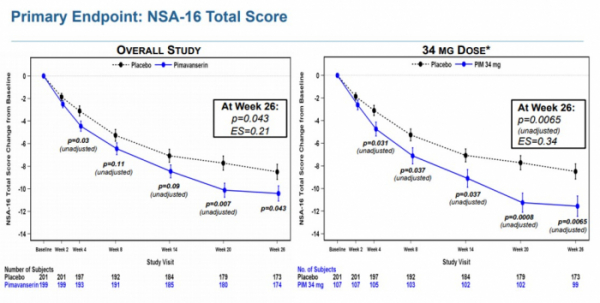
▲피마반세린 NSA-16 분석 결과(아카디아 파마슈티컬스 발표자료 참조)
미국 국립정신건강연구소(National Mental Health Institute)에 따르면 미국 인구 1%가 조현병을 앓고 있다. 조현병은 사고(thinking)장애, 감정적 반응(emotional reaction), 행동장애 등의 증상을 보이는 만성적인 진행성 정신질환(progressive mental illness)이다.
이런 증상은 양성증상(positive symptom)과 음성증상으로 구분한다. 정상인에게 나타나지 않는 양성증상인 환각, 망상과 같은 일반적으로 보이는 반응이 없어진 음성 증상인 흥미상실(loss of interest), 정서적 위축(emotional withdrawal), 인지장애(cognitive disturbances) 등이 있다. 정신분열증에 대한 치료제는 양성증상을 표적으로 하지만, 대부분 환자는 음성증상이 치료되지 않고 유지된다.
한편 아카디아는 중추신경계 질환의 의학적 미충족 수요군(unmet needs)을 해결하기 위해 의약품 개발, 상용화에 중점을 둔 회사로 파킨슨병 관련 환각, 망상 치료제를 개발해 상용화했다.
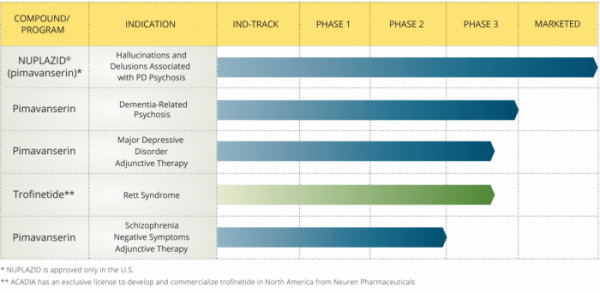
▲파이프라인(아카디아 파마슈티컬스 홈페이지 참조)














![[인사]한미그룹 2026년 정기 임원인사](https://img.etoday.co.kr/crop/77/77/2071974.jpg)



