국제
시애틀, '치료불응' HER2+ 유방암 2상서 ‘PFS 2배 개선’
바이오스펙테이터 서일 기자
[2019 SABCS] 타이로신 키나아제 저해제 '투카티닙', HER2 양성 유방암 2상서 대조군 대비 ORR 1.5배 이상, PFS 2배 이상, OS 1.5배 이상 개선

시애틀제네닉스가 기존 치료제에 불응시 치료대안이 없는 전이성 HER2 유방암에 대한 치료제의 상업화 임상에서 긍정적인 결과를 내놨다. 특히 항체 위주인 기존치료제와는 달리 HER2 타깃하는 저분자 화합물로 뇌로 전이된 유방암 환자에서도 좋은 결과가 나왔다. 이번 결과에 대해 시장에서는 '놀랍다', '게임체인저'라는 등의 긍정적인 반응을 보였다.
시애틀제네틱스는 지난 11일(현지시간) 2019 샌안토니오 유방암학회(2019 San Antonio Breast Cancer Symposium, SABCS)에서 전이성 HER-2 양성 유방암 환자 대상 ‘투카티닙(tucatinib)’의 상업화 임상 2상에 대한 긍정적 결과를 내놨다. 이 결과는 같은 날 국제학술지 NEJM(New England Journal of Medicines)에도 게재됐다(DOI: 10.1056/NEJMoa1914609).
투카티닙의 HER2CLIMB 임상 2상에 참여한 환자는 HER2 양성 유방암 표준 치료제에 속하는 '트라스트주맙', '퍼투주맙', ‘캐싸일라(Kadcyla, 성분명: ado-trastuzumab emtansine, T-DM1)’로 치료받은 경험이 있는 환자들로 구성됐다. 이들 치료제에 반응하지 않은, 전이성 HER2 양성 유방암 환자들은 치료옵션이 없다. 그리고 이 중 뇌로 전이된 환자는 약 48%였다. 이번 임상에서 투카티닙은 트라스트주맙과 카페시타빈과 함께 삼중으로 투여됐다. 대조군은 트라스트주맙과 카페시타빈에 플라시보(placebo)를 추가해 진행했다.
라쉬미 머티(Rashmi Murthy) MD앤더슨 유방종양학과 조교수는 “표준 치료법인 트라스트주맙, 퍼투주맙, ‘캐싸일라(Kadcyla, ado-trastuzumab emtansine, T-DM1)’로 치료받은 전이성 HER2 양성 유방암 환자는 암이 더 진행될 경우 적용할 치료요법이 없으며, 특히 뇌전이가 발생한 환자들은 대표적인 미충족 수요군이다”며 “투카티닙의 HER2CLIMB 임상 2상(NCT02614794) 결과는 뇌전이 유무에 관계없이 치료제로 가능성을 보여준다”고 말했다.
발표에 따르면 투카티닙은 이번 유방암 환자를 대상으로 한 임상에서 모든 임상 지표를 개선시킨 결과를 보였다. 투카티닙은 질병진행 또는 사망위험을 46% 감소시키며 1차 종결점을 충족시켰다(HR=0.54 [95% CI: 0.42, 0.71], p<0.00001). 치료 후 1년된 시점에서 투카티닙은 대조군과 비교해 무진행생존율(Progression-free survival, PFS) 33%(vs 12%)로 암이 진행하지 않으면서 생존한 환자의 비율이 2배이상 높았다. mPFS(median PFS)도 7.8개월(vs 5.6개월)을 보였다.
투카티닙은 2차 종결점인 전체생존기간(overall survival, OS)을 증가시킴으로써 사망위험을 34% 감소시켰다(HR = 0.66 [95% CI: 0.50, 0.88], p=0.0048). 치료후 2년이 된 시점에서 투가티닙과 대조군을 비교한 OS는 45%(vs 27%), 평균 OS는 21.9개월(vs 17.4개월)을 보였다. 2년된 시점에서 생존 환자의 비율이 45%로 대조군 27%에 비해 월등히 높은 결과였다.
특히 뇌로 전이된 환자군에서 우수한 결과를 보였다. 투카티닙은 뇌 전이 환자군에서 질병진행 또는 사망위험이 52% 감소한 결과를 보였다(HR=0.48 [95% CI: 0.34, 0.69], p <0.00001). 치료 후 1년된 시점에서 투카티닙은 대조군과 비교해 PFS는 25%(vs 0%), mPFS는 7.6개월(vs 5.4개월)을 보였다.
투카티닙은 전제 반응률을 1.5배 이상 개선시켰다. 평가 가능한 환자(511/612)에서 투카티닙은 대조군과 비교해 전체반응률(objective response rate,ORR) 40.6%(vs 22.8%, p=0.0008)을 보였다.
투카티닙은 내약성에서도 대조군과 비슷하거나 약간 떨어졌다. 투카티닙군에서 가장 흔하게 보이는 부작용은 설사 80.9%(vs 53.3%), 적혈구 감각 증후군 63.4%(vs 52.8%), 구역질 58.4%(vs 43.7) 피로감45%(vs 43.1%) 등이었다. 3 등급 이상 부작용은 설사 12.9%(vs 8.6%), 간 효소AST(aspartate aminotransferase)증가 4.5%(vs 0.5%) 를 보였다. 부작용으로 임상시험 참여를 포기한 환자 비율은 투카티닙 투여그룹 5.7%, 위약그룹 3.0%였다.
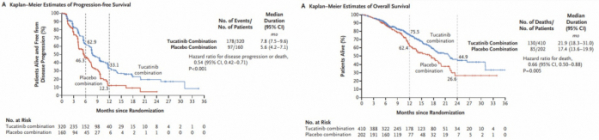
▲투카티닙 PFS, OS 결과(NEJM 논문 참조 DOI: 10.1056/NEJMoa1914609)
투카티닙은 기존 치료제와 다른 기전을 가진다. 저분자 화합물인 투카티닙은 HER-2 단백질의 세포내 타이로신 키나아제(tyrosine kinase) 도메인에 결합해 인산화(phosphorylation) 작용을 저해해 세포증식 신호를 막는다. 다른 HER2 타깃 항체 치료제인 트라스트주맙, 퍼투주맙은 HER2의 세포외부 도메인에 결합해 세포 증식 신호를 저해한다. 시애틀제네틱스는 지난 2018년 1월 캐스캐디언 테라퓨틱스(Cascadian Therapeutics)를 6억1400만달러에 인수하며 투카티닙을 파이프라인으로 확보했다.
로저 댄시(Roser Dansey) 시애틀 제네틱스 최고의료책임자는 “투카티닙은 대조군과 비교하여 전체 생존기간, 무진행생존율, 전체 반응률에서 의미있는 결과를 보였다”며 “2020년 1분기까지 미국 식품의약국 (FDA)에 신약신청서(NDA)을 제출하고 판매허가신청(MAA)을 유럽의약품청(EMA)에 제출할 계획이다”고 말했다
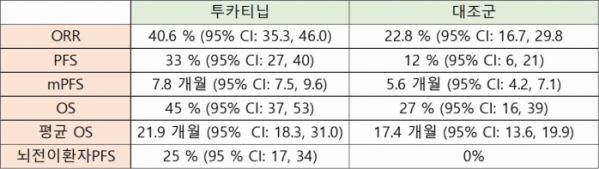
▲투카티닙 임상 결과 정리(바이오스펙테이터 재구성(EJM 논문 참조DOI: 10.1056/NEJMoa1914609)















