국제
카이트, MCL 치료 'CAR-T' 美 허가 신청.."CR 67%"
바이오스펙테이터 봉나은 기자
CD19 표적 CAR-T ‘KTE-X19’, BTK 저해제 치료 실패한 외투세포 림프종(MCL) 환자 대상 2상서 ORR 93%, CR 67% 결과..내년 초 유럽 허가도 신청

길리어드의 카이트파마(Kite Pharma)가 재발성/불응성 외투세포 림프종(Mantle cell lymphoma, MCL) 환자 치료제로 CD19를 표적하는 CAR-T치료제 ‘KTE-X19’에 대한 생물의약품 허가신청서(BLA)를 미국 식품의약국(FDA)에 제출했다고 11일(현지시간) 발표했다.
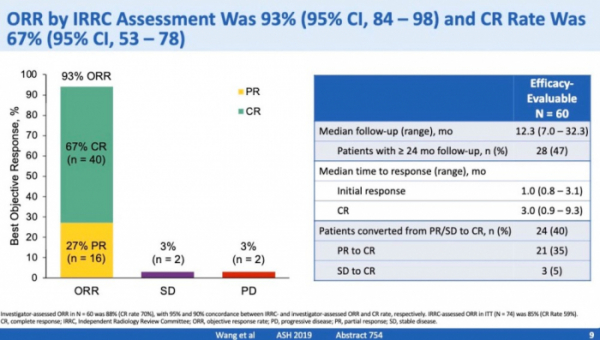
카이트는 ZUMA-2 임상2상(NCT02601313)에서 전체반응률(ORR) 93%, 완전반응률(CR) 67%를 확인한 결과에 기반해 BLA를 제출했다.
KTE-X19는 B세포 항원인 CD19를 표적하는 CAR-T로, CD19 scFv에 CD3ζ T세포 활성 도메인과 CD28 신호전달 도메인이 결합된 ‘예스카르타(Yescarta)’와 구조가 같다. 다만 KTE-X19와 이미 CD19 CAR-T 치료제로 FDA 승인을 받은 예스카르타의 차이점은 카이트의 XLP™ 제조과정에 있다. 카이트는 환자에서 채취한 자가 면역세포로부터 순환종양세포(Circulating Tumor Cell, CTC)를 분리하고, 특정 B세포 악성종양에 효과적으로 작용하는 순환 림프구를 강화시키는 과정에 차이가 있다고 설명했다.
이러한 KTE-X19는 임상에서 고무적인 결과를 보였다.
ZUMA-2 임상에는 이전에 최대 5회까지 치료받은 이후 재발하거나 불응성을 보인 외투세포 림프종 환자 74명이 등록됐다. 환자는 체내 잔여 림프구를 제거하는 전처치 치료제(conditioning chemotherapy)로 3일동안 ‘플루다라빈(fludarabine)’ 30mg/m^2/d과 ‘사이클로포스파마이드(cyclophosphamide)’ 300mg/m^2/d를 투여받은 이후, ‘KTE-X19’ 2×10^6 CAR-Tcells/kg를 1회 정맥투여 받았다.
카이트가 지난 9일(현지시간) 2019 미국 혈액학회(ASH)에서 발표한 ZUMA-2 임상 결과에 따르면, 올해 7월 24일까지의 데이터 컷 오프(data cut-off) 결과 중 평가 가능한 환자 60명에게서 전체반응률(ORR) 93%, 완전반응률(CR) 67%가 확인됐다. 약 12.3개월(중간값, 7.0~32.3) 동안 관찰한 결과로, 이들 중 47%는 24개월 이상 결과를 관찰했다. 12.3개월까지의 관찰 기간동안 무진행생존기간(PFS)과 전체생존율(OS)은 중간값에 도달하지 않았다.
▲카이트 ZUMA-2 임상결과(2019 미국 혈액학회(ASH))
임상 초기에 부분반응(PR)을 보이거나 안정병변(SD)를 보인 환자의 40%는 완전반응(CR)으로 효능이 진전됐으며 완전반응을 보이기까지 3개월(중간값, 0.9~9.3)이 걸렸다.
안전성 프로파일은 공격형(aggressive) 비호지킨 B세포 림프종(NHL) 환자를 대상으로 한 이전 임상 결과와 일치했다. 사이토카인 방출 증후군(CRS)이나 신경독성으로 사망한 사례는 관찰되지 않았으며, 대부분의 이상반응 증상은 치료 초기에 나타났다가 완화된 것으로 확인됐다.
KTE-X19의 차별성은 BTK 저해제 치료에 실패한 외투세포 림프종 환자에게서도 반응이 높게 나타났다는데 있다.
최근 몇년간 외투세포 림프종 환자에게 임브루비카(Imbruvica)와 같은 BTK 저해제를 적용해 반응률이 향상된 결과를 관찰했으나, BTK 저해제로 치료한 이후에도 질환이 진행된 환자의 예후는 좋지 않은 것으로 알려져 있다.
그러나 ZUMA-2 임상에 등록된 환자는 모두 BTK 저해제를 투여받은 경험이 있고, 이전에 평균 2회의 치료를 받은 환자이며 이들에게 KTE-X19를 적용한 결과, 높은 반응률이 확인된 것이다.
Ken Takeshita 카이트 글로벌 임상개발 부문 책임자는 “적절한 환자들에게 신속하게 치료제를 전달할 수 있도록 FDA와 협력할 예정”이며, “길리어드(카이트)의 두 번째 CAR-T 치료제를 통해 산업을 주도하는 세포 치료제 개발 프로그램을 이어가겠다”고 말했다.
한편, 카이트는 2020년 초 유럽 의약품청(EMA)에 시판허가 신청서(Marketing Authorization Application, MAA)를 제출할 계획이다. 카이트의 KTE-X19는 최근 FDA의 혁신 치료제(BTD), EMA의 우선심사(PRIME) 대상으로도 지정된 바 있다.



















