국제
바이오젠, '아두카누맙 재투여' 3상 시작.."허가일정은 미정"
바이오스펙테이터 김성민 기자
이전 임상 참여 초기 알츠하이머병 환자 대상 아두카누맙 재투여 임상3b상 개시...아두카누맙 허가일정 '올해 초→미정' 입장 변화 "가능한 빨리 규제 신청할 것"
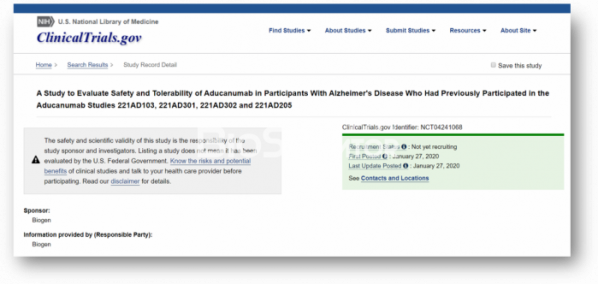
▲clinicaltrials.gov에서 새롭게 업데이트된 아두카누맙 임상개발 현황.
바이오젠이 이전 임상에 참여했던 초기 알츠하이머병 환자를 대상으로 아두카누맙을 다시 투여하는 오픈라벨 임상3상을 시작했다.
바이오젠이 지난 27일 미국 임상정보사이트(clinicaltrials.gov)에 업데이트한 정보에 따르면 31일부터 아두카누맙을 재투여(re-dosing)하는 임상3b상을 시작한다(NCT04241068). 임상은 2023년 9월에 종료될 예정이다.
이전 아두카누맙 임상1상, 임상2상, 두개의 임상3상(221AD103, 221AD301, 221AD302, 221AD205)에 참여했던 초기 알츠하이머병 환자 2400명을 대상으로 한다. 일차 목표는 아두카누맙 또는 플라시보 약물을 투여받았던 환자에게 아두카누맙을 재투여해 장기간 노출에 따른 안전성, 내약성을 평가하는 것이라고 기재했다.
그러나 아두카누맙의 허가 일정은 불투명한 상황이다. 업계의 기대와는 달리 바이오젠은 지난 30일 열린 지난해 4분기 실적발표 자리에서 바이오젠은 구체적인 규제 신청 일정을 업데이트하지 않았다. 지난해 10월 바이오젠은 중간 결과와 달리 추가적으로 진행한 임상3상 결과 아두카누맙을 투여한 그룹에서 위약 대비 통계적으로 유의미한 차이를 확인했으며, 올해초 신약허가를 위한 서류를 제출하겠다고 발표한 바 있다.
구체적인 시점에 대한 질문에 대해 마이클 부나토스(Michel Vounatsos) 대표는 "가능한 빠른 시일내에 미국 규제당국에 서류 제출을 완료하기 기대한다"라는 답변만 내놨다.
이에 업계에서는 바이오젠이 허가 과정에 차질이 생긴것이 아니냐는 우려도 나왔다.
이날 바이오젠은 "여러 임상에 걸쳐 고용량의 아두카누맙을 장기간 투여해 약물을 충분히 노출할 경우 인지저하를 늦췄다"며 "향후 미국에 이어 유럽과 일본 규제당국과도 논의할 계획"이라고 밝혔다.
그밖에 바이오젠은 독성을 띈다고 알려진 아밀로이드 베타 올리고머~피브릴 결합 'BAN2401' 임상3상과 더불어 3개의 타우 신약으로 △타우 N-terminal 타깃 항체: BIIB092(gosuranemab), 임상2상 △pan-타우 항체: BIIB076, 임상1상 △pan-타우 분해 ASO: BIIB080, 임상1상 등 개발을 진행하고 있다.
한편 이날 바이오젠의 주가는 1.77% 하락했다.





![[인사]일동제약그룹, 임원인사 발령](https://img.etoday.co.kr/crop/74/74/2275874.jpg)








![[인사]일동제약그룹, 임원인사 발령](https://img.etoday.co.kr/crop/77/77/2275874.jpg)