기업
韓 '코로나19' 임상 6건 승인.."렘데시비르·칼레트라 등"
바이오스펙테이터 장종원 기자
식약처 집계 현황..렘데시비르, 허가용(2건)·연구용 1건 진행..치료목적 사용승인 7건

국내에서 신종코로나바이러스 감염증 관련 6건의 임상이 승인 받은 것으로 나타났다. 전세계적으로 연구가 활발한 렘데시비르, 칼레트라, 클로로퀸뿐 아니라 최근 한국파스퇴르연구소가 제안한 시클레소니드(상품명 알베스코)도 임상 승인을 받았다. 렘데시비르 2건을 제외하고는 모두 학술연구용 임상이지만 모두 대상자 수를 100명 이상으로 늘려 많은 코로나19 환자들이 치료의 기회를 얻도록 한 것도 특징이다.
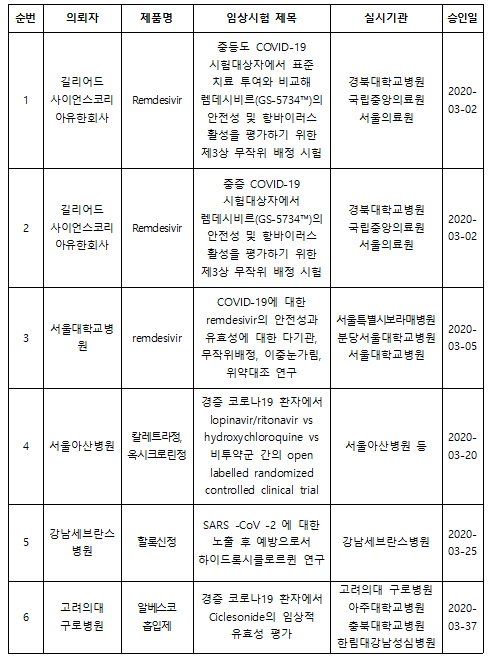
28일 식품의약품안전처에 따르면 코로나19 관련 임상시험이 총 11건이 신청됐으며 이중 6건이 승인된 것으로 나타났다(27일 기준).
이미 알려진대로 길리어드사이언스가 글로벌하게 진행하는 중등도(120명), 중증(75명) 코로나19 환자에게 렘데시비르를 적용하기 위한 임상 3상 2건이 허가용으로 진행되고 있다. 이와 별도로 서울대병원은 코로나19 환자 100명에게 렘데시비르의 안전성과 유효성을 확인하기 위한 학술연구용 2상을 승인받았다.
서울아산병원은 경증 코로나19 환자 150명에게 HIV-1 감염치료제인 칼레트라와 옥시크로린정(히드록시클로로퀸) 병용 투여하는 연구자 임상시험을 승인받았다. 강남세브란스병원도 코로나19 환자에게 할록신정(히드록시클로로퀸)을 처방하는 연구자 임상시험을 승인받았다.
한국파스퇴르연구소가 최근 세포수준의 실험을 통해 코로나19 치료제로 제안한 천식치료제 '알베스코(성분명 시클레소니드)'도 임상에 돌입한다. 고려의대 부속 구로병원은 지난 27일 경증 코로나19 환자 141명에게서 임상적 유효성 평가하는 연구자 임상을 승인받았다.
식약처는 또한 임상시험 중인 의약품을 코로나19 치료 목적으로 사용할 수 있도록 7건을 승인했다. 이뮨메드의 'HzVSF v13주'가 6건, 파미셀의 'Cellgram-AKI'가 1건으로 나타났다. 다만 치료목적 사용승인은 신약허가 절차와는 무관하며 이 결과로는 치료제의 유효성을 입증할 수도 없다.
식약처는 이번에 승인된 임상이 신속하게 진행될 수 있도록 ‘코로나19 관련 임상시험 고려사항’을 마련했다고 설명했다. ①임상시험심사위원회(IRB)에서 코로나19 관련 임상시험을 우선 심의하고 ②화상회의 등 비대면 방식으로 심의하며 ③격리된 상황 등을 고려해 전화설명으로 임상시험 대상자 동의 가능하도록 한 내용이다.
또한 국내 허가가 없는 의약품도 코로나19 치료를 위해 질병관리본부가 요청하는 경우 '특례수입'을 허용했다. 이에 따라 국내 허가되지 않은 ‘칼레트라액’을 3차례 특례수입 조치됐다고 설명했다.
식약처 관계자는 "현재 코로나19 치료에 사용하는 ‘칼레트라정’과 ‘히드록시클로로퀸정’ 등의 국내 공급 현황을 모니터링해 필요한 경우 수입 또는 생산될 수 있도록 대비하고 있다"면서 "칼레트라정은 약 1만 5000명분, 히드록시클로로퀸정은 약 20만명분을 업체에서 보유하고 있다"고 덧붙였다.














![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)



