기업
수젠텍, 코로나19 신속진단키트 "美 FDA 승인 획득"
기사입력 : 2020-09-07 09:15수정 : 2020-09-07 09:15
바이오스펙테이터 김성민 기자
코로나19 항체 신속진단키트 'SGTi-flex IgG' FDA EUA 승인..."NCI 성능평가서 민감도 97%, 특이도 100%"
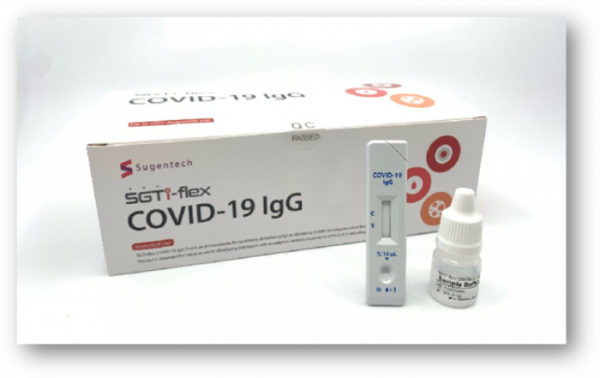
▲수젠텍의 코로나19 항체신속진단키트
수젠텍이 국내 최초로 코로나19 항체 신속진단키트에 대한 미국 식품의약처(FDA) 긴급사용승인(EUA)을 획득했다. 지금까지 미국 FDA의 긴급사용승인을 받은 항체 신속진단키트는 수젠텍을 포함해 14개다.
수젠텍은 코로나19 항체 신속진단키트 'SGTi-flex IgG'가 미국 국립암센터(NCI) 성능평가를 통과해 국내 최초로 FDA의 긴급사용승인을 받았다고 7일 밝혔다.
수젠텍의 코로나19 항체 신속진단키트는 FDA 승인 과정에서 진행된 NCI 성능평가에서 민감도 97%와 특이도 100%를 기록했다. 수젠텍에 따르면 미국 FDA 승인 기준인 민감도 90%와 특이도 95%다.
현재 미국과 유럽 등 선진국에서는 '항체 신속진단키트'를 분자진단(RT-PCR)과 함께 사용하고 있는 상황이다. 국가별 방역 정책에 따라 확진자 판별뿐 아니라 과거 감염 이력과 완치자의 일상생활 복귀여부를 판단하는데에도 항체 신속진단키트가 사용한다는 설명이다. 방역 인프라가 부족한 개발도상국과 후진국에서도 분자진단의 대안으로 항체 신속진단키트를 활용하고 있다.
손미진 수젠텍 대표는 "예상보다 시간이 오래 걸렸지만, 미국 FDA의 엄격한 평가 기준 통과해 수젠텍의 기술력과 품질을 인정받아 기쁘다”며 “조만간 미국 수출이 본격화될 뿐 아니라 'FDA 인증 승인 진단키트'라는 품질적인 차별성이 부각돼 미국 외 지역의 수출도 많이 증가할 것”이라고 말했다.













![[BioS 레터]무균주사제 공급망 변화와 CDMO 대응](https://img.etoday.co.kr/crop/77/77/2262816.jpg)


