남궁석 SLMS(Secret Lab of Mad Scientist) 대표
[단백질 구조부터 신약까지⑥]최초의 막단백질 결정화..이온채널 및 GPCR 구조 규명
지금까지의 연재에서 설명한대로 1990년대에 이르면서 재조합 단백질 생산기술, 방사광가속기 유래의 X선 이용 등의 여러가지 기술적인 진보에 따라 많은 질병 관련 단백질들의 결정구조가 속속 규명되었다. 그러나 이러한 와중에서도 유독 결정화가 어려웠던 단백질은 바로 세포와 외부를 구분하는 생체막에 존재하는 '막단백질(Membrane Protein)'이다.
막단백질은 단순히 생체막의 표면에 붙어있는 막단백질부터, 생체막을 가로지르는 생체막 횡단 나선(Transmembrane Helix)를 통하여 막 외부 도메인과 세포질내 도메인으로 나누어지는 단백질, 그리고 채널(Channel)이나 G단백질 연계 수용체(G-Protein Coupled Receptor, GPCR)와 같이 단백질이 여러개의 막 횡단 나선으로 구성되어 생체막을 중심으로 구조를 형성하고 있는 단백질 등 여러 부류로 나뉜다. 생체막에 결합하는 막 외부와 세포질에 각각 별도의 도메인으로 나뉘어 있는 단백질은 각각의 부분을 별도의 재조합 단백질로 만드는 방법을 통하여 결정화할 수 있었지만, GPCR이나 채널처럼 생체막을 중심으로 3차원구조를 형성하고 있는 단백질들은 결정화 자체가 거의 불가능에 가까웠다.
그렇다면 막단백질은 왜 결정을 만들기가 어려울까? 이는 막단백질이 세포 내에 존재하는 독특한 환경에 기인한다. 막단백질은 세포막 내에 존재하고, 이를 세포 내에서 분리하여 정제하기 위해서는 일단 생체막을 용액에 녹여내야 한다. 이를 위해서는 여러가지 계면활성제(=비누와 비슷한 성질을 가진 물질)를 사용해야 하는데, 계면활성제를 찾아서 단백질을 녹여내는 조건을 찾기도 쉽지 않았다. 그리고 단백질을 정제한 다음에 결정을 형성하려면 일단 단백질이 근접하여 뭉쳐야 된다. 그러나 막 내부에 존재하는 막단백질의 특성상 물과 친하지 않은 부분들이 많이 분포하는 경우가 있고, 이러한 경우 단백질은 응집되어 침전이 형성되고 결정화는 되지 않는 경우가 많다. 그리고 계면활성제로 둘러싸인 막단백질에서 계면활성제 성분은 한쪽에는 강한 극성, 다른 쪽에는 물과 친하지 않은 소수성의 성질을 가지고 있는데, 강한 극성인 부분은 서로 반발력을 일으킬 것이므로, 단백질간의 접촉을 방해하는 경우가 많다.
이러한 여러 이유로 막단백질을 결정화하는 것은 단백질 결정학이 완성된 1950년대에서 약 30여년이 지난 1980년대 중반까지도 불가능한 일로 여겨졌다.
그러나 막단백질은 이렇게 구조연구가 힘들었지만 상당수의 막단백질이 약물의 타깃임을 생각한다면 일단 구조가 규명된다면 의약품의 개발에 매우 중요한 역할을 하게된다. 가령 혈압조절제인 암로디핀(Amlodipine)은 칼슘채널 차단제이며, 중추신경계에 작용하는 많은 약물들 역시 막단백질을 표적으로 한다. 인간 유전체 내에 존재하는 약 800개의 GPCR 중 108개의 GPCR이 미국에서 승인된 약물 중 약 34%에 해당하는 475개 의약품의 표적이다. 이렇게 막단백질은 약물의 표적으로 중요하지만 단백질의 구조정보가 거의 없었으므로 구조기반 약물설계 및 개선의 이득을 볼 수 없었고 많은 시행착오를 겪어야만 했다. 또한 단백질의 구조가 알려지지 않았으므로 각각의 막단백질이 분자수준에서 어떻게 작동하는지에 대한 정보 역시 세포질 내의 단백질에 비해서 매우 미흡했다. 그러나 거의 불가능한 난제라고 생각되는 막단백질의 구조결정도 서서히 돌파구가 열리기 시작했다.
최초의 막단백질 결정화
비록 많은 사람들이 관심을 가지고 있었던 막단백질은 인간과 같은 동물유래의 막단백질이었지만, 1980년대에느 동물의 막단백질을 대량으로 얻는 것도 쉽지 않았고, 따라서 연구자들의 주된 연구대상은 그나마 많은 양의 막단백질을 상대적으로 용이하게 얻을 수 있는 세균의 막단백질이 주류를 이루었다.
최초로 결정화에 성공한 막단백질은 광합성 세균(Rhodopseudomonas viridis)에서 빛 에너지를 받아들인후, 이 에너지를 전자의 형태로 변환하여 궁극적으로 세포질 내에 수소이온의 형태의 화학 에너지로 변환하는 역할을 하는 광합성 반응 중심(Photosynthetic reaction centre)였다. 광합성 반응 중심은 광합성을 하는 식물 및 세균 등 다양한 생물에 존재하지만, 이 세균에 존재하는 광합성 반응 중심은 4개의 단백질 가닥으로 이루어진 가장 간단한 단백질이었다. 1982년 독일 막스 플랑크 연구소의 하르무트 미첼(Harmut Michel)은 이 세균의 생체막에서 광합성 반응 중심을 정제하고 결정을 만드는 데 성공하였다.[1] 단백질 결정학자인 요한 다이센호퍼(Johann Deisenhofer)와 로베르트 후버(Robert Huber)와의 협력 연구에 의해서 약 3년간의 노력을 통하여 광합성 반응 중심의 구조가 풀렸다.[2] 풀린 광합성 반응 중심은 크게 4개의 단백질로 구성되어 있었고, 생체막의 바깥에는 사이토크롬 서브유니트, 생체막을 관통하는 L, M 서브유니트, 그리고 세포질 내의 H 서브유니트의 구성으로 되어 있었고, L, M 서브유니트에는 실제로 빛과 처음 접촉하여 전자를 방출하고 이를 전달하는 과정에 있는 일련의 화합물들이 관찰되었고, 이 화합물들은 생체막을 통과하고 있는 5개의 알파나선 내에서 갇혀져 있었다. 미첼, 다이센호퍼, 후버는 1988년 이 단백질 구조를 푼 공로로 노벨 화학상을 수상했다.
1994년에는 대장균에서 ATP를 만들어 내는 효소인 F1-ATPase의 구조가 규명되었다.[3] 이 단백질은 세균의 세포막 혹은 미토콘드리아의 내막에 존재하는 단백질로써, 세포막 내부와 외부의 수소 이온 농도차이에서 발생하는 전기적인 신호를 운동 에너지로 바꾸어 ATP형태의 화학 에너지로 바꾸어 주는 단백질이다. 이 단백질은 세포막에 존재하는 수소 이온을 통과하는 부분과, 그 위에 붙어 있는 ATP를 합성하는 부분으로 나뉘어 있는데, 수소 이온 농도차이에서 나오는 전위차이를 운동에너지로 바꾸고, 이에 따라서 운동에너지를 ATP 형태의 화학에너지로 바꿔주는 기능을 한다. 이 단백질의 구조 규명에 참여한 캠브리지 대학의 존 워커(John Walker)는 1997년 노벨 화학상을 수상하였다.
이렇게 1990년대 중후반까지 주로 세균 유래의 막단백질의 구조가 한두개씩 풀리기 시작했다. 그러나 신경 전달과 세포의 신호 전달에 핵심적인 역할을 하고, 수많은 의약품의 표적인 이온채널과 GPCR의 구조는 여전히 요지부동이었다. 경험이 있는 구조생물학자들이라면 ‘불가능한 프로젝트'라고 하여 도전할 엄두를 내지 못하고 있던 이들 단백질 구조에서 돌파구를 찾은 사람들은 아이러니컬하게도 이전에 단백질 구조를 연구하지 않던 연구자들이었다.
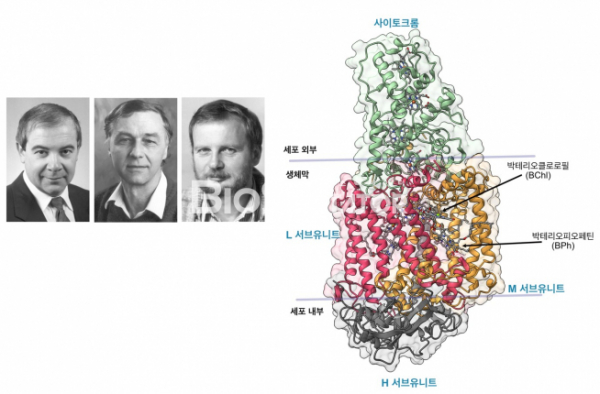
▲그림1. 최초로 규명된 막단백질인 광합성 세균유래의 광합성 반응 중심(Photosynthetic reaction center). 이 단백질은 세포 외부에 나와있는 사이토크롬, 생체막 안에 존재하는 L, M 서브유니트, 세포 내부의 H 서브유니트의 4개 단백질 가닥으로 되어있다. L, M 서브유니트 내부에 존재하는 박테리오클로로필(BChl) 이 빛을 받아들인후 전자를 박테리오페오피틴(BPh)로 전달하고, 이 전자가 사이토크롬으로 전달되어 결과적으로 양성자 형태의 전기 에너지로 바뀌는 과정을 수행하게 된다. 요한 다이센호퍼(Johann Deisenhofer), 로베르트 후버(Robert Huber), 하르무트 미첼(Hartmut Michel)은 이 구조를 규명한 공로로 1988년 노벨 화학상을 수상한다.
로데릭 맥키넌과 이온채널의 구조 규명
세포막은 기름에 친한 부분과 물과 친한 부분을 동시에 가지고 있는 지질 이중막 구조로 되어 있으며, 정상적인 경우 이온과 같이 전하를 띄고 있는 물질은 기름과 친한 막으로 구성된 세포막을 뚫고 들어갈 수 없다. 그러나 세포에서는 이온을 선택적으로 투과시켜 여러가지 생명 현상을 유도하게 되며, 이를 위해서는 세포막에 이온의 통과를 위한 ‘구멍'을 뚫어야 한다. 이렇게 세포막에서 이온을 투과할 수 있는 ‘구멍' 의 역할을 하는 단백질이 바로 이온채널이다. 가령 신경세포가 전달하는 전기적 신호는 세포의 밖과 안의 이온의 다른 조성에 의해서 만들어진다. 가령 신경전달물질에 의해서 전달되는 전기적 신호는 소디움 채널에 의한 세포내의 빠른 유입에 의해서 전압이 올라간 후, 이러한 전압에 의해서 포타슘 채널이 열려서 세포 밖으로 방출됨으로써 형성된다. 이를 위해서는 생체막에서 어떻게 우리가 원하는 이온만을 선택적으로 투과시킬 수 있어야 한다.
대부분의 이온채널은 이온에 대한 선택성을 가지고 있다. 가령 소듐(Na+) 이온과 포타슘(K+) 이온은 둘다 1+의 전하를 띄는 이온이지만, 소듐 이온을 통과시키는 소듐 채널은 소듐만 통과시키고 포타슘은 통과시키지 않으며, 포타슘 채널 역시 포타슘만 선택적으로 통과시킨다. 소듐 이온보다 포타슘 이온이 크기가 크므로, 소듐 채널은 소듐은 통과하지만 포타슘이 통과할 수 없을만큼 작은 구멍이 있다고 한다면 소듐 채널의 선택성은 설명 가능하다. 그러나 소듐보다 큰 포타슘이 통과할 수 있는 포타슘 채널을 왜 소듐은 통과할 수 없을까? 이러한 현상을 발견한 생리학자 클레이 암스트롱(Clay Armstrong)은 1970년대에 채널에 이온이 통과할 수 있는 ‘선택성 필터'라는 부분이 있을 가설을 세웠다. 그러나 과연 이 선택성 필터는 어떻게 구성되어 있을까? 이온채널의 단백질의 구조도 모르고, 단백질의 서열조차 몰랐던 1980년대 이전에는 이를 해결할 수 있는 방법이 없었다.
로데릭 맥키넌(Roderick Mackinnon)은 브랜다이스 대학교 학부를 다니며, 세포막 내로 칼슘을 통과시키는 칼슘 채널에 대한 연구를 한 후 학을 졸업한 이후 의대에 진학하여 내과의사가 되었다. 그러나 연구에 대한 열정을 가지고 있던 맥키넌은 임상의 생활에 싫증을 느꼈고, 수련의 수련 도중 자신이 학부때 연구하던 연구실로 되돌아와 포타슘 채널에 대한 연구를 전기생리학적인 방법을 통하여 수행하였고, 1989년 하버드 대학 의대에 조교수로 임용된 이후에도 연구를 계속하였다. 그는 당시 처음 등장한 채널 유전자에 대한 연구를 통하여 채널을 구성하는 어떤 아미노산이 ‘선택성 필터'를 구성하는지에 대한 것을 알아냈다. 그러나 단백질 구조가 없는 상태에서 어떻게 이 아미노산들이 선택성 필터로써 포타슘 이온만을 선택적으로 통과시키는지를 알 수 없었다. 결국 이 문제를 해결하기 위해서는 포타슘 채널의 구조를 규명해야 했다. 그러나 그가 이 문제를 상의한 대부분의 X선 결정학자는 막단백질의 단백질 결정학, 특히 채널의 결정학은 불가능하다고 생각하여 거절하였고, 그는 이전에 X선 결정학에 대한 연구 경험이 전혀 없음에도 불구하고 스스로 X선 결정학으로 포타슘 채널의 구조를 풀겠다는 매우 무모한 계획을 세웠다.
그는 1994년 록펠러 대학으로 이직하면서 연구 방법론을 완전히 바꾸어 X선 결정학으로 이온채널의 구조를 풀 것을 계획했다. 이 과정에서 대부분의 연구실 구성원들은 맥키넌의 무모한 도전에 동참하지 않았고, 새로운 연구실에서 맥키넌과 함께 결정학 연구를 시작한 것은 연구실 테크니션으로 같이 일하던 그의 부인과 포스트닥 1명뿐이었다.
맥키넌은 그 시점에서 동물 유래의 포타슘 채널의 구조를 지금 푸는 것은 무리라고 생각하고, 그 당시에 풀린 대부분의 막단백질처럼, 보다 간단한 세균 유래의 포타슘 채널의 구조를 모델 시스템으로 풀려고 하였다. 세균의 포타슘 채널은 2개의 막 통과 알파 나선을 가지고 있어서 6-8개의 막 통과 알파 나선을 가지고 있는 동물의 포타슘 채널보다 훨씬 더 간단한 구조를 가지고 있었지만, 선택성 필터로 추정되는 부분에는 동물과 거의 일치하는 아미노산 서열을 가지고 있었고, 따라서 세균 유래의 포타슘 채널의 구조를 알게 되면 이것이 동물 유래의 포타슘 채널에 대한 정보를 줄 것이라고 생각했다.
그는 여러 종류의 세균 유래의 포타슘 채널을 테스트하던 중 Streptomyces lividans라는 세균 유래의 포타슘 채널인 KcsA의 결정화에 성공하였고, 1998년 최초의 결정 구조를 얻을 수 있었다.[4] 이렇게 얻어진 세균 유래의 포타슘 채널은 4가닥의 단백질이 모여 구조를 형성하고 있었고 중앙에 이온이 통과할 수 있는 구멍이 형성되어 있었다. 동물에서 세균까지 보존되어 있는 선택성 필터는 생체막 바깥에서 내부로 들어오는 입구 영역에 존재하였다. 선택성 필터를 구성하고 있는 아미노산 잔기들의 카르복실기는 이온이 들어올 수 있는 구멍 쪽으로 도열되어 있었으며, 그 크기는 정확히 포타슘 이온이 4개의 카르복실기의 산소와 같은 거리로 상호작용할 수 있는 거리였다. 포타슘 이온보다 작은 소디움 이온의 경우 4개의 카르복실기 중에서 2개만 상호작용할 수 있으므로 채널을 통과할 수 없는 것이다. 이후 맥키넌 연구팀은 2002년 염소 채널의 구조를 결정하였고, 동일한 단백질 4개가 대칭적으로 배열되어 이온이 통과하는 구멍을 형성하는 포타슘 채널과는 달리, 염소 채널은 2개의 단량체가 생체막 방향으로 서로 반대의 방향으로 분포하고, 각각의 단량체 내에 염소 이온이 통과하는 구멍이 존재하는 구조였다.[5]
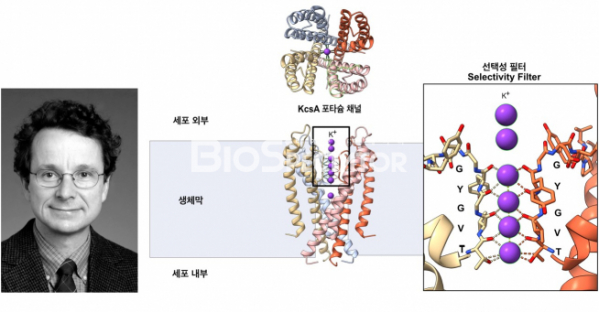
▲그림2. 최초의 이온 채널의 단백질 구조와 채널의 선택성의 기전을 발견한 로데릭 맥키넌과 세균 유래의 포타슘 채널(KcsA)구조. 포타슘 채널은 4개의 서브유니트로 이루어져 있으며, 포타슘 이온은 가운데의 구멍(Pore)로 통과한다. 채널의 선택성을 결정하는 선택성 필터(Selectivity Filter)에는 세균으로부터 진핵생물까지 보존되어 있는 ‘TVGYG’ 아미노산 서열이 있으며, 이들 아미노산의 카르복실기는 이온 채널을 통과하는 포타슘 이온과 정확히 배위 결합을 형성하여 포타슘 이온만을 선택적으로 통과시킨다.
이러한 이온채널의 구조를 처음으로 규명하여 채널의 선택성에 대한 이해를 넓혀준 공로로 맥키넌은 2003년 노벨 화학상을 수상하였다. 그러나 아직도 상당수의 채널들의 구조는 규명되지 않은 상태였다.
GPCR의 구조 규명
GPCR은 수많은 약물과 신경전달물질의 수용체로 작용하여 세포 내로 신호를 전달하는 역할을 하는 관계로 이전부터 많은 생화학자 및 약리학자들의 관심을 끌었다. 그러나 막단백질이라는 성격 때문에 이들의 구조는 1990년대 중반까지 완전히 미지수였다.
최초로 결정화되어 구조가 풀린 GPCR은 망막의 간상세포에 존재하는 단백질로써, 빛이 들어오면 이를 감지하여 신경계로 신호를 전하는 단백질인 로돕신(Rhodopsin)이다. 2000년 미국 워싱턴 대학과 일본 리켄의 협동 연구팀은 로돕신이 7개의 생체막을 통과하는 알파 나선으로 구성되었으며, 빛을 받으면 구조를 변형시키는 색소 물질인 레티날은 로돕신의 7개 생체막 안에 결합되어 있었다.[6] 2000년에 구조가 풀린 것은 아직 빛을 받기 전인 레티날과 로돕신으로써 아직 비활성화된 상태이다. 이후 빛을 받아 로돕신의 구조가 변형되어 G단백질이 활성화되고 간상세포 내로 소디움 이온이 유입되어 신경세포의 신호가 활성화되어 신경계를 거쳐 뇌로 신호가 전달되게 된다. 이러한 과정을 모두 이해하기 위해서는 활성화된 GPCR의 구조, GPCR과 G단백질의 복합체 등 단백질의 다양한 상태에 대한 구조 정보가 필요했다.
최초로 구조가 풀린 GPCR이 로돕신이 된 이유는 로돕신은 망막의 간상세포에 많이 분포하고 있어서 도축장 등에서 얻은 소의 안구 조직 등에서 대량으로 얻을 수 있었고, 계면활성제를 이용하여 효율적으로 로돕신을 정제할 수 있는 방법을 찾았기 때문이다. 이에 비해서 다른 GPCR은 대량으로 얻기가 곤란하였고, 정제한 이후에 금방 불활성되었다. 따라서 이를 해결하기 위해서는 결정화를 할 수 있는 시료를 대량으로 확보하는 것부터 필요했다.
이러한 어려움으로 지지부진하던 GPCR 구조 규명에서 비약적인 발전을 이룩한 사람은 스탠포드 대학교의 브라이언 코빌카였다. 원래 내과의사였던 코빌카는 아드레날린의 약리효과에 관심을 가지게 되었고, 아드레날린의 수용체인 베타2 아드레날린 수용체(B2AR)에 대한 연구를 시작하였다. 처음 분자생물학적인 방법으로 B2AR를 연구하던 코빌카는 곧 여기에 한계를 느끼고, B2AR 의 성질에 대한 생물물리학적인 연구를 수행하려고 했다. 이를 위해서는 정제된 단백질이 다량으로 필요했으나, 로돕신과 같이 조직에서 대량으로 분리할 수 있는 GPCR과는 달리 B2AR은 조직에서 그리 많이 분포하지 않았다. 이를 극복하기 위하여 곤충세포에서 B2AR를 대량으로 배양하고 정제할 수 있는 방법을 개발했다.[7]
이제 생물물리학적인 연구가 가능한 수준의 양의 단백질을 확보할 수 있게 되자, 코빌카는 단백질에 형광물질을 결합한 후, 수용체에 결합하는 물질에 따라서 단백질의 구조가 변화한다는 것을 알게 되었다.[8] 그렇다면 구체적으로 이러한 단백질의 구조와 이 변화는 어떻게 이루어졌을까? 이를 위해서는 결국 단백질의 고해상도 구조가 필요했다. 그러나 GPCR 구조 규명은 너무 성공 가능성이 희박하고 실패시에 위험부담이 많은 연구라 이를 수행하고자 하는 포스트닥이나 박사과정 학생을 찾기 어려웠다. 연구책임자였던 코빌카는 자기 자신이 직접 결정화 실험을 수행하였고, 결정은 쉽게 만들어지지 않았다. 결정화를 시도한지 약 6년만인 2004년 코빌카는 작은 결정을 얻었으나, 이 결정은 잘 회절하지 않았고, 구조를 푸는데 필요한 고해상도의 정보를 획득하는데는 실패하였다. 그러나 이러한 결과는 결정화가 불가능하다고 생각하던 B2AR의 결정화가 가능하다는 것을 의미하였으며, 구조 규명 연구에 동참하는 포스트닥들이 등장하였다.
결정화가 잘 되지 않고, 결정화되어도 X선을 잘 회절하지 않은 이유로 단백질의 세포막 밖으로 돌출되는 부분이 너무나 동적으로 움직힌다는 것을 깨달은 연구진들은 이를 해결하기 위해서 몇 가지 방법을 동원했다. 한 가지는 세포막 밖으로 돌출되는 부분에 결합하는 항체를 만들어, 동적으로 움직이는 단백질에 ‘자물쇠'를 채우는 것이었으며 또 다른 방법은 이러한 부분을 제거하고, 결정화가 잘 되는 단백질인 T4 라이소자임을 대신 붙여놓는 것이다. 또 다른 기술적인 발전은 막 단백질을 실제 세포내의 환경과 비슷한 지질 환경에서 결정화할 수 있는 LCP(Lipid Cubic Phase) 환경에서 결정화를 수행하여 GPCR의 결정화 성공률을 높인 것이다. 이러한 기술적 진보에 의해 2007년 B2AR의 결정 구조가 최초로 규명되었으며,[9] 비슷한 방법론에 의해서 다른 종류의 GPCR의 결정화에 성공하여 구조가 속속 등장하였다.
그런데 이렇게 얻은 구조들은 대개 GPCR이 비활성화된 상태에 있는 구조들이었다. GPCR에 리간드가 결합하여 구조가 변화하여 어떻게 G단백질을 활성화시키는지를 알기 위해서는 활성화된 형태의 GPCR의 구조를 알아야만 한다. 그러나 GPCR의 경우 이를 활성화하는 리간드가 결합된 상태에서는 제대로 결정화되지 않았는데 그 이유는 활성화된 GPCR은 동적인 움직임의 변화가 더욱 커지기 때문이었다.
결국 이를 해결하기 위해서는 새로운 방법론이 필요했었고, 그 해결책이 된 방법 중의 하나는 통상적인 동물 유래 항체보다 더 작은 항체인 라마 유래의 항체인 나노바디(Nanobody)를 이용하여 활성화된 GPCR의 형태를 고정시키는 것이었고, 다른 하나는 아예 G단백질과 결합된 GPCR 복합체 전체의 구조를 파악하는 것이었다.
이렇게 2011년 G단백질과 결합된 활성화된 GPCR 수용체 복합체의 구조가 등장했고, GPCR을 활성화하는 리간드가 결합한 상태에서는 GPCR 수용체의 구조는 G단백질이 결합하는 세포 내의 부분에서 크게 변화하였고, GPCR 수용체의 구조는 결합된 G단백질의 구조 변화를 유발하여 G단백질의 GDP를 GTP로 변화하게 하여 활성화시킨다는 것을 알게 되었다[10]. 이렇게 여러가지 기술의 발전과 다년간의 노력에 의해서 GPCR이 어떻게 외부의 신호전달물질에 결합하여 이 신호를 세포 내로 전달하는지에 대한 분자적인 기작이 확립되었고, 이는 우리의 GPCR에 대한 이해를 좀 더 깊게 해 주었다. 브라이언 코빌카는 2013년 GPCR에 대한 구조 연구의 공로로 노벨 화학상을 수상하였다.
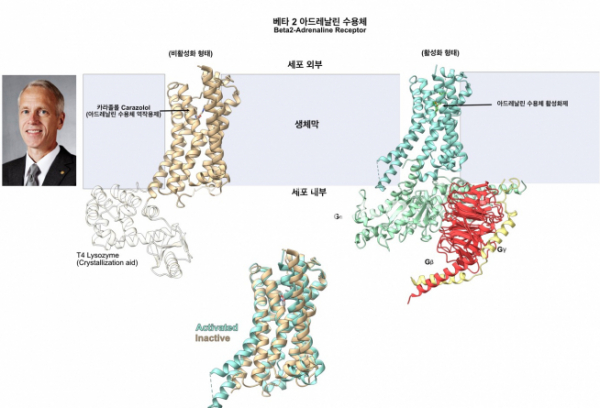
▲그림3. 대표적인 GPCR인 베타-2 아드레날린 수용체의 구조. 아드레날린 수용체 역작용제인 카라졸롤에 결합되어 비활성화 상태인 베타 2 아드레날린 수용체와 활성화된 베타 2 아드레날린 수용체의 GPCR 구조에는 미묘한 변화가 생긴다. 이러한 변화 때문에 G단백질과 결합하고, G단백질의 GDP가 GTP 로 치환되어 이펙터로 작용하여 세포 신호를 전달하게 된다. 브라이언 코빌카(Brian Kobilka)는 베타-2 아드레날린 수용체를 비롯한 수많은 GPCR 의 구조에 대한 선도적인 연구로 2013년 노벨 화학상을 수상했다.
이렇게 막단백질의 결정화는 여러가지 테크닉의 발전에 의해서 쉽지는 않았지만 천천히 이루어졌고, 여기서 도출되는 정보는 이온채널이나 GPCR 같은 중요한 막단백질의 기전을 이해하는데에 꼭 필요한 정보를 제공하게 되었다. 그러나 기술이 발전하였다고 하더라도 여전히 막단백질 등과 같은 단백질의 결정화는 매우 많은 시간과 노력이 걸리는 일이었고 실패율 또한 높았다. 또한 막단백질 이외에도 세포 내에는 여러가지 단백질이 결합되어 생물학적인 기능을 수행하는 다양한 단백질 복합체들이 존재하는데, 이들 중 상당수는 결정화되지 않아서 구조 분석이 불가능한 상태였다. 과연 결정화가 불가능한 단백질에 대한 구조를 분석하는 방법은 없을까?
그러나 2010년대 이후 이러한 상황에 극적인 진전이 일어났는데, 그것은 단백질 결정화 이외에도 단백질의 고해상도 구조를 풀 수 있는 또 다른 방법의 대두이다. 여기에 대해서는 다음 연재에서 알아보도록 한다.
참고문헌
1. Michel, H. (1982). Three-dimensional crystals of a membrane protein complex: the photosynthetic reaction centre from Rhodopseudomonas viridis. Journal of Molecular Biology, 158(3), 567-572.
2. Deisenhofer, J., Epp, O., Miki, K., Huber, R., & Michel, H. (1985). Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at 3Å resolution. Nature, 318(6047), 618-624.
3. Abrahams, J. P., Leslie, A. G., Lutter, R., & Walker, J. E. (1994). Structure at 2.8 A resolution of F1-ATPase from bovine heart mitochondria. Nature, 370(6491), 621-628.
4. Doyle, D. A., Cabral, J. M., Pfuetzner, R. A., Kuo, A., Gulbis, J. M., Cohen, S. L., ... & MacKinnon, R. (1998). The structure of the potassium channel: molecular basis of K+ conduction and selectivity. science, 280(5360), 69-77.
5. Dutzler, R., Campbell, E. B., Cadene, M., Chait, B. T., & MacKinnon, R. (2002). X-ray structure of a ClC chloride channel at 3.0 Å reveals the molecular basis of anion selectivity. Nature, 415(6869), 287-294.
6. Palczewski, K., Kumasaka, T., Hori, T., Behnke, C. A., Motoshima, H., Fox, B. A., ... & Miyano, M. (2000). Crystal structure of rhodopsin: AG protein-coupled receptor. science, 289(5480), 739-745.
7. Kobilka, B. K. (1995). Amino and carboxyl terminal modifications to facilitate the production and purification of a G protein-coupled receptor. Analytical biochemistry, 231(1), 269-271.
8. Gether, U., Lin, S., & Kobilka, B. K. (1995). Fluorescent labeling of purified β2 adrenergic receptor: evidence for ligand-specific conformational changes. Journal of Biological Chemistry, 270(47), 28268-28275.
9. Rasmussen, S. G., Choi, H. J., Rosenbaum, D. M., Kobilka, T. S., Thian, F. S., Edwards, P. C., ... & Kobilka, B. K. (2007). Crystal structure of the human β2 adrenergic G-protein-coupled receptor. Nature, 450(7168), 383-387.
10. Rasmussen, S. G., DeVree, B. T., Zou, Y., Kruse, A. C., Chung, K. Y., Kobilka, T. S., ... & Kobilka, B. K. (2011). Crystal structure of the β2 adrenergic receptor–Gs protein complex. Nature, 477(7366), 549-555.


















