국제
프리미어 투자 Nohla, '제대혈 조혈모세포' 치료제 잠재력
바이오스펙테이터 이은아 기자
시리즈B 5600만달러 유치, "임상2상 'Dilanubicel' 백혈병 치료 가능성 확인".."progenitor-CARs, NK세포 등도 개발중"

'Off-the shelf' 세포치료제 개발기업 Nohla Therapeutics가 최근 후속 투자를 받으면서 시리즈B로 총 5600만달러(약 632억원)을 모금했다. Nohla는 암 및 기타질병 환자를 대상으로 줄기세포이식에서 골수 대신 제대혈 유래 조혈모세포 치료법을 개발하는 회사다. 'Nohla(No HLA)'라는 회사명에서 볼 수 있듯이 제대혈 조혈모세포는 환자의 조직적합성항원(HLA)을 일치할 필요가 없어 골수 기증자를 찾기 못한 환자들에게 새로운 대안을 제공할 수 있다.
이번 시리즈B는 ARCH Venture Partners가 리드했으며, Fidelity Management and Research Company, 셀진(Celgene Corporation), 5AM Ventures, Alexandria Venture Investments, AML Biotech Partners 등 유명 바이오·제약 투자기관들이 대거 참여했다.
특히 후속 시리즈B의 신규 투자자로 국내 프리미어파트너스가 참여했다는 점도 주목할 만하다. 그 외 일본의 Tokyo Edge Capital과 Schroder Adveq가 투자했다.
2015년 12월 설립된 Nohla의 선두 파이프라인 ‘Dilanubicel(NLA101)'은 골수 이식의 단기적인 효과를 보완하도록 고안된 제대혈 유래 조혈모세포다. ex-vivo에서 세포 수를 증폭시킨 동종유래 ’기성품(Off-the Shelf)' 치료제로 2~3주간의 짧은 골수이식 효과를 장기간 지속시킨다는 장점을 갖는다. 흥미로운 점은 제대혈 조혈모세포는 골수이식에 비해 조직적합성항원(HLA) 일치 조건이 덜 까다롭다는 것이다. 기존 환자유래 세포치료제나 환자의 HLA와 일치해야하는 동종 세포치료법과는 차별화되는 포인트다. 현재 Dilanubicel는 2건의 임상2상이 진행 중이다.
Nohla는 확보된 투자금으로 Dilanubicel의 임상개발에 본격 나선다. Katie Fanning 대표는 "시리즈B에 핵심적인 글로벌 투자자들이 참여해서 기쁘다"면서 "이번 투자금은 선두 파이프라인 ‘Dilanubicel(NLA101)'의 동종이식 및 급성골수성백혈병(AML)의 임상시험에 투입할 예정이다. Nohla의 독자 플랫폼에서 발견한 후속 프로그램을 개발하는데도 사용할 것“이라고 밝혔다.
◇ 백혈병 치료 새로운 대안 'Dilanubicel' 임상2상 진행중.."희귀의약품, 신속심사 지정"
Nohla는 시애틀의 프레드 허친슨 암연구소(Fred Hutchinson Cancer Research Center)에서 제대혈을 기증 받아 줄기세포치료제를 개발한다. 파이프라인 Dilanubicel은 급성골수성백혈병(AML) 제대혈 이식 환자와 고용량 항암치료 받은 AML 환자를 대상으로 임상2상을 진행하고 있다.
먼저, AML 제대혈 이식 임상2b상 시험부터 보자. 기존의 제대혈 이식은 낮은 세포 수로 사용이 제한적이었다. 골수 또는 말초혈액 유래 조혈모세포와 비교해 제대혈 줄기세포와 전구세포가 10분의 1정도만 포함돼 있다. 따라서 골수 및 말초혈액 줄기세포이식 환자보다 초기 생착(engraftment)까지 시간이 오래 걸려 이식관련 이환율 및 사망률이 높은 편이다.
Nohla는 제대혈 이식환자에 Dilanubicel을 추가로 주입해 신속하게 혈액 및 면역세포를 생산할 수 있는 줄기세포와 전구세포(progenitor cells)를 현저하게 증가시킴으로써 기존 한계를 극복하고자 한다. 임상 중간결과 Dilanubicel은 제대혈 이식과 관련된 이환율 및 사망률을 감소시키고 환자의 평균 생존율을 향상시키는 고무적인 결과를 얻었다. 지난달 스웨덴에서 열린 ‘제23차 유럽혈액학회(EHA)’에서 발표한 내용에 따르면, 이식수술 5년 후에도 환자 86%(13/15명)가 여전히 생존했으며 암이 재발되지 않았다. 줄기세포 이식환자의 주요 관심사인 심각한 이식편대숙주병(GVHD)를 경험한 환자도 발견되지 않았다. 제대혈 이식받은 백혈병 환자에서 Dilanubicel의 주입으로 부작용 없이 안전, 신속하게 호중구, 혈소판 회복을 가져왔다는 의미다.
이 결과를 바탕으로 Dilanubicel은 EMA로부터 조혈모세포이식(HSCT) 환자의 치료를 위해 신속심사 프로그램인 ‘우선순위 의약품(PRIME, Priority Medicines)’과 희귀의약품(Orphan Drug)으로 지정받았다.
현재 미국에서 제대혈 이식받은 백혈병 환자 160명을 대상으로 진행 중인 임상2상은 올해 말 탑라인 결과를 발표할 계획이다. 임상에는 급성골수성백혈병, 급성림프성백혈병, 만성골수성백혈병, 골수이형성증후군 환자가 포함된다.

▲Nohla Therapeutics의 일부 파이프라인 개발현황 (회사 홈페이지 참조)
두 번째 임상은 고용량 항암요법을 받은 AML 환자 220명을 대상으로 한다. 미국, 호주, 한국에서 진행 중이며, 국내 사이트로는 가천대길병원과 서울대학병원 등이 있다. 고용량 화학치료를 받게되면 환자의 40%가 생명을 위협하는 심각한 감염증상을 경험한다. 따라서 화학치료를 지연시키거나 줄이게 되는데 결국 화학요법 효능을 감소시키게 된다.
Dilanubicel는 고용량 화학요법 치료경험이 있는 환자에게 화학요법으로 인한 호중구 감소증과 관련된 감염률을 감소시키는 것이 목표다. 이미 임상1상에서 안전성은 확인됐다. 클로파라빈(clofarabine), 시타라빈(cytarabine), G-CSF priming 요법을 받은 AML 환자 29명에서 GVHD, 독성, 면역 부작용은 관찰되지 않았다. 대조군에 비해 감염증 발생률도 현저하게 감소했다.
◇ Notch 리간드 플랫폼기술, "progenitor-CARs, NK세포 등 개발"
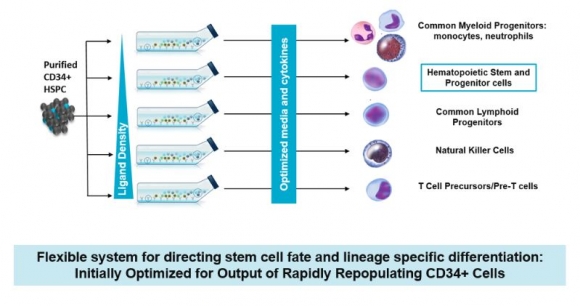
▲Nohla Therapeutics의 Notch 리간드 플랫폼기술 (회사 홈페이지 참조)
Nohla는 후속 파이프라인으로 면역조절 및 면역유도, 유전자 변형 줄기세포치료제, CAR-progenitor, NK 세포치료제 등도 개발하고 있다.
다양한 Off-the shelf 세포치료제 개발을 가능케한 Nohla의 무기는 Notch 리간드 플랫폼기술이다. 줄기세포의 수 및 분화 조절하는 신호전달에 관여하는 Notch 리간드인 델타1(Delta1)를 조작해 CD34+ 제대혈 줄기세포와 전구세포를 분리, 증폭시킬 수 있다.


















