기업
국내 '임상시험 정보 등록제도' 언제 도입될까?
바이오스펙테이터 장종원 기자
작년 9월 입법예고한 '임상 정보공개 의무화법' 법제처 심사단계 진입..2019년 시행 예정
국내 임상시험 정보 등록제도 도입이 늦어지고 있다. 미국 FDA, 유럽 EMA 등의 임상시험 정보공개 강화 흐름에 발맞춰 국내도 과감하게 추진됐지만 업계 반발 등에 부딪혀 관련 법안이 아직 심사 단계에 머물러 있다. 다만 식약처는 임상시험 정보 등록제도가 환자의 접근성을 높이는 제도인만큼 반드시 도입하겠다는 입장이다.
28일 업계에 따르면 식품의약품안전처가 작년 9월 입법예고한 ‘의약품 등의 안전에 관한 규칙’ 개정령안이 약 8개월이 지난 현재까지 심사가 진행중인 것으로 나타났다. 시행규칙이 개정되는 입법예고(40~60일), 규제 심사(15~20일), 법제처 심사(20~30일), 공포 등의 진행절차를 감안하면 꽤 늦어지고 있는 것이다.
이 개정령안은 국내에서 임상을 진행하는 제약사, 바이오텍, 임상시험대행업체(CRO) 등이 임상시험 진행단계별로 관련 자료를 제출하고, 식약처는 해당 정보를 공개토록 하는 내용을 담고 있다. 임상시험 정보의 공개 범위를 대폭 확대해 환자들의 임상시험 접근성을 높이고, 임상시험의 부정적인 결과 비공개 방지 등을 통해 임상시험의 객관성과 투명성을 확보하겠다는 취지다.
구체적으로 임상시험계획승인을 받은 자는 식약처 홈페이지 등을 통해 임상시험계획서에 포함된 임상시험계획서(최초 시험대상자 선정 전), 최초 및 최종 시험대상자 등록 현황(30일 이내), 최종 시험대상자 관찰 종료 현황(20일 이내), 임상시험 실시상황(매년 실시상황 다음해 3월말까지), 임상시험 결과(최종 시험대상자 관찰 종료 후 1년 이내) 등을 제출·등록해야 한다. 식약처는 제약기업 등이 제출한 임상시험 실시상황 정보를 홈페이지 등을 통해 공개한다.
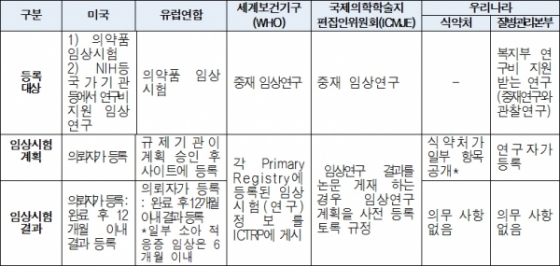
▲국내외 임상시험 정보 공개 현황 비교(자료: 식품의약품안전처)
임상시험 정보 등록제도가 시행되면 진행 중인 임상시험 실시상황을 매년 공개해야 하기 때문에 임상실패 여부를 은폐하는 관행이 상당 부분 개선될 것으로 기대됐다. '임상시험 실패는 없는데 나오는 제품도 없는' 국내 모순된 임상시험 환경에 대한 것이다. 특히 미국 FDA 등은 의약품 임상시험 결과를 완료 후 12개월 이내에 등록토록 하는 등 전세계 정보공개 강화 흐름에 발맞춘다는 측면에서도 의미가 컸다.
하지만 법률안이 입법예고 후 관련 기관의 의견을 받는 과정에서 임상시험 정보 공개를 새로운 규제로 인식한 제약사 등 업계의 반발이 적지 않았던 것으로 알려졌다. 특히 기업의 전략적 프로젝트를 단계별로 알리는 것은 물론 연구의 성공과 실패 여부까지 실시간으로 공개하는 데 대한 부담을 호소했다. 업계 관계자는 "국내 바이오제약 신약파이프라인이 충분치 않은 상황에서 부정적인 정보가 실시간으로 공개되면 시장에 큰 혼란을 줄 수 있다"고 했다.
이에 대해 식약처는 임상시험 정보 등록 강화는 환자의 접근성을 높이는 것은 물론 전세계적인 흐름이라면서 제도 도입을 자신했다. 식약처 관계자는 "제도 도입에 대해 일부 회사들의 부정적 의견이 있어 심의가 늦어진 것은 사실이지만 이로 인해 제도 도입 철회는 없다"면서 "현재 법안의 마지막 단계인 법제처 심사에 진입해 조만간 결론이 나올 것"이라고 말했다. 임상시험 정보 등록 제도는 법안 공포 후 1년 뒤에 시행된다. 식약처는 법안이 공포되는 대로 임상시험 정보등록 시스템을 구축하고 시범운영을 추진해 2019년 제도를 본격 시행하겠다는 계획이다.

















