기업
에이치엘비, 리보세라닙 병용요법 국내 임상1/2a상 승인
기사입력 : 2018-10-02 13:46수정 : 2018-10-02 13:46
바이오스펙테이터 김성민 기자
1차 표준 치료 실패 38명 진행성 위암 또는 위식도접합부암 환자 대상
에이치엘비는 자회사 LSKB가 지난 1일 식품의약품 안전처로부터 위암에서 '리보세라닙' 병용요법 임상 1/2a상 승인을 받았다고 2일 밝혔다.
임상시험은 1차 표준 치료에 실패한 38명의 진행성 위암 또는 위식도접합부암 환자 대상으로 리보세라닙과 기존 항암제 ‘파클리탁셀’을 18개월간 병용투여한다. 위암 환자에서 3차 치료제로 리보세라닙 글로벌 임상 3상을 마무리하는 단계에서 적응증 확대 임상을 시작했다.
임상 1상에서 9~18명 환자 대상으로 파크리탁셀(80mg/㎡)과 리보세라닙 병용투여의 최대 내약용량을 확인하고, 임상 2상 적정 용량을 확정한다. 이후 20명 환자에서 병용투여 요법의 유효성을 확인할 계획이다.
전이성 위암 2차 치료제로 사이람자(라무시루맙)와 파크리탁셀 병용요법이 있다. 혈관내피세포수용체-2(VEGER-2) 차단한다는 공통점이 있지만, 사이람자는 주사제인 반면 리보세라닙은 경구투여 약물이라는 점이 다르다.
회사 관계자는 “중국을 제외한 위암 2차 치료제 시장을 약 5조 규모로 추정되며, 리보세라닙은 우월한 약효와 뛰어난 안전성을 바탕으로 위암치료제 시장에서 좋은 성과를 기대한다”며 “향후 임상 글로벌 임상으로 확장할 계획”이라고 밝혔다.
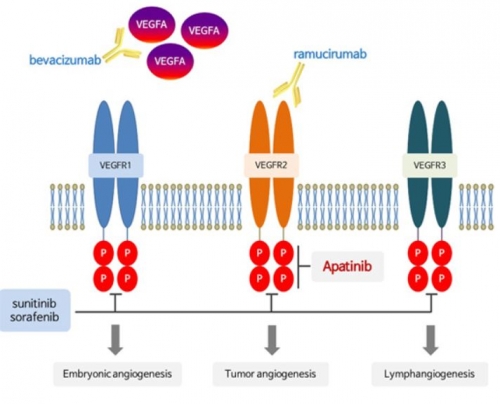
▲리보세라닙 작용기전, 에이치엘비 홈페이지 자료


















