국제
캐리오팜, 'XPO1 저해제' 지방육종 2/3상 "PFS 개선"
바이오스펙테이터 윤소영 기자
경구용 XPO1 저해제 ‘엑스포비오’, 탈분화형 지방육종 2/3상서 병의 진행 및 사망 위험 30% 낮추며 "1차 종결점 충족"

캐리오팜 테라퓨틱스(Karyopharm Therapertics)가 '엑스포비오(Xpovio®, selinexor)'의 새로운 적응증인 지방육종(liposarcoma)에 대한 임상 2/3상에서 긍정적인 결과를 냈다. 엑스포비오는 다발골수종(multiple myeloma)과 미만성거대B세포림프종(Diffuse Large B-Cell Lymphoma, DLBCL)치료제로 미국 식품의약국(FDA) 승인받은 약물이다.
캐리오팜은 지난 2일(현지시간) 엑스포비오 SEAL 임상 2/3상(NCT02606461) 결과 절제가 불가능한 진행성 탈분화형 지방육종(advanced unresectable dedifferentiated liposarcoma) 환자들의 무진행생존기간(Progression-Free Survival, PFS)을 통계적으로 유의미하게 증가시켜 1차 종결점을 충족시켰다고 발표했다.
이번 SEAL 임상 2/3상은 두 번 이상의 치료를 받은 절제 불가능 진행성 탈분화형 지방육종 환자 342명을 대상으로 진행했다. 임상에서 환자들은 매주 2번씩 60mg의 엑스포비오 혹은 위약(placebo)을 투약했다. 또한 위약군 환자 중 병의 진행이 확실하게 나타나는 환자들은 엑스포비오군으로 변경할 수 있게 했다. 임상의 일차 종결점은 무진행생존기간(PFS)이었다.
캐리오팜은 임상 결과 PFS의 위험비(Hazard Ratio, HR)가 0.70(p=0.023)으로 나타났다고 발표했다. 이는 엑스포비오군에서 병의 진행이나 사망에 대한 위험이 위약군 대비 약 30% 줄었다는 것을 의미한다. 또한 캐리오팜은 위약군에서 엑스포비오군으로 변경한 환자들의 전체생존율(Overall Survival, OS) 중간값이 위약군으로 계속 진행한 환자들에 비해 향상됐다고 설명했다. 큰 부작용 이슈도 나타나지 않았다.
세부적인 임상 결과 내용은 오는 20일 온라인으로 개최되는 CTOS(Connective Tissue Oncology Society)연례 회의에서 발표할 예정이다.
Sharon Shacham 캐리오팜 CSO는 “이번 탑라인 결과는 표준 치료제 없이 제한적인 치료옵션만이 가능했던 진행성 탈분화형 지방육종 환자들에게 특히 좋은 소식”이라며 “이번 적응증에 대한 미국 FDA의 승인이 기대되고, 이번 결과는 엑스포비오의 다른 고형암 적응증인 자궁내막암, 교모세포종, 폐암 등의 임상을 발전시킬 수 있는 근거가 될 것”이라고 말했다.
엑스포비오(Xpovio®, selinexor)는 Exoprotein1(XPO1)의 작용을 저해하는 경구용의 SINE(Selective Inhibitor of Nuclear Export)다. XPO1은 p53, FOXO등 종양억제 단백질을 핵 밖으로 운송하는 단백질이다. 종양억제 단백질은 핵 속에서 DNA 변이를 감지하여 암세포로의 성장을 막으며, 일부 암환자들에서 XPO1이 정상에 비해 과발현된다는 연구결과가 있다. 캐리오팜은 엑스포비오가 XPO1과 결합, 핵 내의 종양억제 단백질이 핵 밖으로 유출되지 못하게 해 종양억제 단백질이 기능을 할 수 있게 한다고 설명한다.
한편, 엑스포비오는 지난해 7월 3번 이상의 치료를 받은 재발성/난치성 다발골수종에 대한 덱사메타손(dexamethasone)과 병용요법 치료제로 FDA 승인을 받았다. 또한 이번 6월에는 재발성의 성인 미만성거대B세포림프종에 대한 치료제로도 적응증을 확대했다.
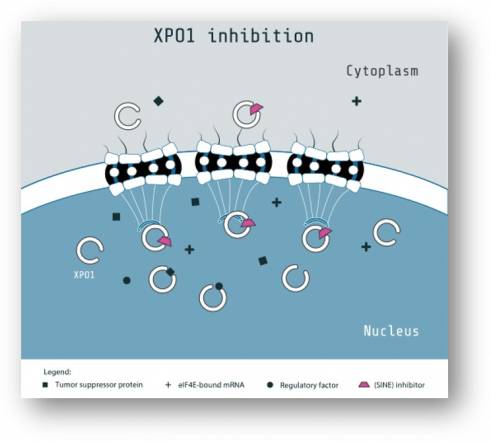
▲SINE 작용 기전 (캐리오팜 홈페이지 참조)
















